Вплив карипразину на когнітивні функції: ретроспективний аналіз клінічних досліджень фази II/III, присвячених біполярній манії, біполярній депресії та шизофренії. Повна версія
У даному розділі
Roger S. McIntyre1*, David G. Daniel2,3, Eduard Vieta4, István Laszlovszky5, Pascal J. Goetghebeur, Willie R. Earley and Mehul D. Patel.
Оригінальне дослідження. CNS Spectrums. www.cambridge.org/cns
Як цитувати: McIntyre RS, Daniel DG, Vieta E, Laszlovszky I, Goetghebeur PJ, Earley WR and Patel MD (2022). The efficacy of cariprazine on cognition: a post hoc analysis from phase II/III clinical trials in bipolar mania, bipolar depression, and schizophrenia. CNS Spectrums https://doi.org/10.1017/S109285292200013X
Received: 26 March 2021. Accepted: 03 February 2022.
Ключові слова: когнітивна діяльність, когнітивні симптоми, біполярний розлад, біполярна депресія, шизофренія, карипразин, ретроспективний аналіз.
Автор для листування: *Roger S. McIntyre, MD. Email: roger.mcintyre@bcdf.org
©AbbVie, Inc., 2022. Published by Cambridge University Press. This is an Open Access article, distributed under the terms of the Creative Commons Attribution licence (http:// creativecommons.org/licenses/by/4.0/), which permits unrestricted re-use, distribution, and reproduction in any medium, provided the original work is properly cited.
Мета. Дослідити вплив карипразину на зміну когнітивних симптомів при біполярному розладі І та шизофренії.
Методи. Був проведений додатковий аналіз 3-8-тижневих базових досліджень біполярної депресії І типу та манії. Також було проаналізоване одне дослідження шизофренії, включно з системою тестування уваги Cognitive Drug Research System.
Цільові результати. Показники Шкали Монтгомері – Асберга для оцінки депресії [MADRS], Короткого тесту оцінки функціонального статусу [FAST], Шкали оцінки позитивних та негативних симптомів [PANSS]. Середні відмінності, обчислені за методом різниці найменших квадратів [LSMDs], у змінах від базового рівня до кінця дослідження були визначені у всіх популяціях пацієнтів, включених у дослідження, і в підгрупах пацієнтів із визначеними початковими рівнями когнітивних симптомів або продуктивності.
1Mood Disorders Psychopharmacology Unit, University of Toronto, Toronto, ON, Canada.
2Signant Health, McLean, VA, USA.
3Department of Psychiatry and Behavioral Sciences, George Washington University, Washington, DC, USA.
4Department of Psychiatry and Psychology, Hospital Clinic, University of Barcelona, IDIBAPS, CIBERSAM, Barcelona, Spain.
5Medical Division, Gedeon Richter Plc., Budapest, Hungary.
6Signant Health, Reading, UK.
7Clinical Development, AbbVie, Madison, NJ, USA.
8Medical Affairs, AbbVie, Madison, NJ, USA.
Результати. У пацієнтів із біполярною депресією та принаймні помірними когнітивними симптомами LSMDs були статистично значущими для карипразину, порівняно з плацебо, за пунктом 6 MADRS (3 дослідження; 1,5 мг = -0,5 [P < 0,001]; 3 мг/день = -0,2 [P < 0,05]) та за когнітивною підшкалою FAST (1 дослідження; 1,5 мг/день=1,4; P=0,0039). У пацієнтів із біполярною манією та принаймні помірними когнітивними симптомами LSMD у когнітивній підшкалі PANSS були статистично значущими для карипразину, порівняно з плацебо (3 дослідження: -2,1; P = 0,001). У пацієнтів із шизофренією та вираженими когнітивними порушеннями покращення концентрації уваги спостерігалося для карипразину у дозі 3 мг/добу, порівняно з плацебо (Р = 0,0080), але не для карипразину 6 мг/добу; покращення безперервності уваги спостерігалося для карипразину в дозі 3 мг/добу (Р = 0,0012) і 6 мг/добу (Р = 0,0073).
Висновок. Ці ретроспективні аналізи надають попередні докази вищої ефективності карипразину, порівняно з плацебо, щодо когнітивних показників у пацієнтів із біполярною депресією I типу, манією та шизофренією, що свідчить про потенційні переваги карипразину в лікуванні когнітивних симптомів.
Вступ
Когнітивні функції охоплюють самостійні процеси, які, проте, де в чому збігаються, включаючи (але не обмежуючись цим) виконавчі функції (наприклад, планування, ініціація поведінки та моніторинг, контролювання імпульсів), увагу, пам’ять і швидкість обробки інформації. Хоча біполярний розлад і шизофренія є різними діагностичними сутностями, заснованими на їхніх клінічних проявах, нейрокогнітивні порушення визнаються основною ознакою обох розладів. Приблизно від 40% до 60% пацієнтів із біполярним розладом і до 75% пацієнтів із шизофренією відчувають когнітивний дефіцит. Хоча деякі дослідження виявили порівняльний ступінь когнітивних порушень у пацієнтів із біполярним розладом і шизофренією, результати інших вказують на те, що пацієнти з шизофренією мають серйозніші та/або поширеніші порушення. Однак при обох розладах когнітивні дефіцити пов’язані з гіршими наслідками та погіршенням якості життя, включаючи більшу кількість госпіталізацій, більшу тривалість хвороби, позитивні й негативні психотичні симптоми, статус без ремісії та нижче психосоціальне функціонування. Оскільки наразі не схвалено жодного терапевтичного засобу для лікування когнітивних порушень у пацієнтів із біполярним розладом або шизофренією, когнітивний дефіцит визнано незадоволеною медичною потребою та новою метою лікування цих захворювань. Хоча дисрегуляція дофаміну визнається причетною до патофізіології як біполярного розладу, так і шизофренії, дані досліджень на тваринах і людях свідчать про те, що дофамінергічна система також відіграє певну роль у когнітивних функціях. Зокрема, рецептори дофаміну D3, ймовірно, пов’язані з когнітивним функціонуванням у здорових людей і в тих, хто має нейропсихічні розлади, з доказами того, що домени пам’яті, уваги, навчання, швидкості обробки інформації, соціального визнання та виконавчої функції потенційно покращуються при блокаді D3-рецепторів і порушуються при агонізмі рецепторів D3. Таким чином, когнітивні показники в осіб із нервово-психічними розладами можуть бути покращені за допомогою блокади рецептора D3, що свідчить про те, що антагоніст/частковий агоніст дофаміну, який сильніше націлюється на рецептори D3, ніж рецептори D2, може мати потенційно сприятливий вплив на когнітивні функції. Проте, важливо зазначити, що когнітивні функції є складним поняттям, і хоча клінічні спостереження підтверджують роль дофаміну D3 у когнітивних функціях у пацієнтів із шизофренією та біполярним розладом I типу, когнітивний дефіцит може мати гетерогенне походження та відбуватися внаслідок залучення інших факторів, включаючи рецептори, відмінні від дофаміну D3.
Карипразин є частковим агоністом рецепторів D3/D2, що надає перевагу дофаміну D3, і частковим агоністом рецептора серотоніну 5-HT1A. Цей препарат схвалений Управлінням з контролю за продуктами й ліками США (FDA) для лікування дорослих із депресією (1,5-3 мг/добу) або маніакальними/змішаними епізодами (3-6 мг/добу), пов’язаними з біполярним розладом I типу та шизофренією (1,5-6 мг/добу). Фармакологія карипразину є унікальною серед лікарських засобів, які модулюють дофамін, демонструючи майже в 10 разів більшу спорідненість до D3-рецепторів, ніж D2-рецепторів in vitro, а також високу та збалансовану зайнятість in vivo рецепторами D3 та D2. На підтвердження потенційної переваги лікування когнітивних симптомів карипразин продемонстрував ефективність на тваринних моделях когнітивних порушень із доказами того, що прокогнітивні ефекти були опосередковані рецептором дофаміну D3. Ефективність карипразину була встановлена в рандомізованих, подвійних сліпих, плацебо-контрольованих базових клінічних дослідженнях фази 2/3 для лікування депресивних епізодів, пов’язаних із біполярним розладом I типу (3 дослідження), гострих маніакальних/змішаних епізодів, пов’язаних із біполярним розладом I типу (3 дослідження) та шизофренією (3 дослідження). Карипразин також продемонстрував широку ефективність щодо окремих симптомів і комплексів симптомів для кожного затвердженого показання.
Щоб дослідити вплив карипразину на когнітивні симптоми при ознаках біполярного розладу типу I та шизофренії, ми провели ретельний аналіз даних, які стосуються зміни когнітивних симптомів. Оскільки складові дослідження не були проспективно розроблені для оцінки когнітивних здібностей, ці аналітичні аналізи були дослідницькими та базувалися на доступних даних для кожного показання.
У разі біполярного розладу типу I більшість представлених аналізів ґрунтувалися на зведених даних основних досліджень біполярної депресії та манії. Також представлено додатковий ретроспективний аналіз, який базувався на когнітивних показниках, зібраних в одному дослідженні біполярної депресії. Раніше повідомлялося про зведений когнітивний аналіз при шизофренії. Результати комп’ютеризованої батареї когнітивних тестів, які були проведені в одному ключовому дослідженні за участю пацієнтів із шизофренією (RGH-MD-04), наведені тут як допоміжний аналіз.
Методи
Ретроспективні (post hoc) аналізи проводилися на основі даних фази 2/3 рандомізованих, подвійних сліпих, плацебо-контрольованих, багатоцентрових, з паралельними групами, клінічних досліджень карипразину при біполярній депресії I типу, біполярній манії I типу та шизофренії. Пацієнти в складових дослідженнях дали інформовану письмову згоду; протоколи досліджень були схвалені інституційною наглядовою радою (центри в США) або комітетом з питань етики/урядовою установою (центри за межами США).
Детальні методи дослідження біполярної депресії I типу, дослідження біполярної манії та дослідження RGH-MD-04 при шизофренії були опубліковані раніше. Коротко кажучи, кожне дослідження мало період виведення тривалістю до 1 тижня, після чого слідував 6-тижневий (дослідження біполярної депресії та дослідження шизофренії) або 3-тижневий (дослідження біполярної манії) період подвійної сліпої оцінки та 2-тижневе наступне спостереження для контролю безпеки. Дорослі пацієнти (біполярний розлад I типу – 18-65 років; RGH-MD-04 [шизофренія] – 18-60 років) відповідали Діагностичному та статистичному посібнику з психічних розладів (DSM-IV-TR або DSM-5)40,41, критеріям біполярного розладу I (гострий маніакальний/змішаний або депресивний епізод) або шизофренії, залежно від захворювання, що досліджувалося. Пацієнтів із біполярною манією I та шизофренією госпіталізували під час скринінгу та принаймні протягом перших 2 тижнів лікування. Ретроспективні аналізи проводили у відповідних популяціях пацієнтів, включених у дослідження, з використанням модифікації шляхом об’єднання та застосування критеріїв підгрупи (модифікована ITT-популяція – mITT).
Учасники досліджень відповідали критеріям включення та виключення, типовим для критеріїв, які використовуються в клінічних дослідженнях біполярного розладу I та шизофренії. У дослідженнях біполярної депресії учасники повинні були мати загальний бал ≥ 20 за шкалою оцінки депресії Гамільтона (HAMD17), бал ≥ 2 – за пунктом 1 і бал загальної тяжкості клінічних вражень (CGI-S) ≥ 4 у біполярному дослідженні. У I дослідженнях манії учасники повинні були мати загальний бал ≥ 20 за шкалою Янга для оцінки манії (YMRS) і ≥ 4 бал принаймні за 2 із 4 пунктів YMRS (дратівливість, мовлення, зміст, руйнівна/агресивна поведінка) та загальний бал за шкалою оцінки депресії Монтгомері – Асберга (MADRS) < 18. У дослідженні шизофренії RGH-MD-04 учасники повинні були мати загальний бал за Шкалою оцінки позитивних та негативних симптомів (PANSS) ≥ 80 і ≤ 120 та бал ≥ 4 принаймні за 2 із 4 пунктів PANSS (марення, галюцинаторна поведінка, концептуальна дезорганізація та елементи підозрілості/переслідування) і бал CGI-S ≥ 4. Ключові критерії виключення в кожному дослідженні включали діагноз DSM, відмінний від досліджуваного розладу, розлади, пов’язані з алкоголем або психоактивними речовинами, протягом визначеного періоду часу (3 місяці для біполярної манії та шизофренії та 6 місяців для біполярної депресії), ризик самогубства та попередню відсутність відповіді на затверджене лікування або резистентність до лікування.
Біполярна депресія 1 типу
Щоб проаналізувати когнітивні симптоми у дорослих пацієнтів із біполярним розладом I типу та нещодавнім епізодом депресії, шеститижневі дані були об’єднані з усіх трьох основних досліджень карипразину. У дослідженнях RGH-MD-53 (NCT02670538) та RGH-MD-54 (NCT02670551) пацієнтів рандомізували (1:1:1) для отримання плацебо або карипразину у дозах 1,5 або 3 мг/добу; у дослідженні RGH-MD-56 (NCT01396447) пацієнти були рандомізовані (1:1:1:1) для отримання плацебо або карипразину 0,75, 1,5 або 3 мг/добу. Подвійний сліпий період становив 6 тижнів у RGH-MD-53 і -54 та 8 тижнів у RGH-MD-56; первинною кінцевою точкою ефективності був шостий тиждень у всіх дослідженнях. Карипразин у дозі 0,75 мг/добу не був включений у ці аналізи, оскільки це нижча доза, рекомендована для біполярної депресії. Основним результатом ефективності в усіх трьох дослідженнях була зміна загальної оцінки MADRS від вихідного рівня до шостого тижня. Короткий тест оцінки функціонування (FAST), шкала, яка складається з 24 пунктів, застосовується лікарями і оцінює 6 сфер функціонування пацієнтів із біполярним розладом (тобто автономність, професійне функціонування, когнітивне функціонування, фінансові проблеми, міжособистісні стосунки і вільний час), застосовувався як додаткова оцінка ефективності лише в дослідженні RGH-MD-56; зміни в результатах FAST оцінювали від вихідного рівня до кінця восьмитижневого подвійного сліпого періоду.
Під час ретроспективного аналізу проводилася оцінка змін від базового рівня до шостого тижня в показниках MADRS Концентрація (пункт 6) і загальних балах шкали MADRS у загальній популяції mITT (mITT – усі пацієнти, які отримували дослідне лікування та мали щонайменше 1 оцінку ефективності після базового рівня) і в 2 підгрупах пацієнтів із вищим рівнем когнітивних симптомів (принаймні легкі когнітивні симптоми = бал за пункт 6 ≥ 3; принаймні помірні когнітивні симптоми = бал за пункт 6 ≥ 4). Оцінки за пунктом 6 коливаються від 0 (немає труднощів із концентрацією) до 6 (нездатність читати чи розмовляти без великих зусиль). Лише в RGH-MD-56 когнітивне функціонування також оцінювалося за змінами від вихідного рівня до восьмого тижня в загальному балі FAST, балах підшкали когнітивного функціонування FAST і балах когнітивних елементів FAST у популяції mITT і в підгрупі пацієнтів із вихідними когнітивними симптомами. Симптоми, визначені як бал підшкали когнітивного функціонування FAST ≥ 2 для 2 або більше з 5 когнітивних питань. Підшкала когнітивного функціонування FAST оцінюється як сума 5 пунктів (здатність зосередитися на книзі/фільмі, робити розумові розрахунки, адекватно розв’язувати проблему, запам’ятовувати нещодавно вивчені імена та вивчати нову інформацію); оцінки варіюються від 0 (немає труднощів) до 3 (серйозні труднощі) для кожного пункту, причому вищі бали вказують на більше порушення.
Біполярна манія 1 типу
Щоб проаналізувати когнітивні симптоми у дорослих пацієнтів із маніакальними або змішаними епізодами, пов’язаними з біполярним розладом I типу, дані всіх трьох основних тритижневих досліджень карипразину були об’єднані. У дослідженнях RGH-MD-31 (NCT00488618) та RGH-MD-32 (NCT01058096) пацієнти були рандомізовані (1:1) для отримання плацебо або змінної дози карипразину від 3 до 12 мг/добу; у RGH-MD-33 (NCT01058668) пацієнти були рандомізовані (1:1:1) для отримання плацебо або фіксованої/гнучкої дози карипразину від 3 до 6 мг/день або від 6 до 12 мг/день. Основним результатом ефективності в кожному дослідженні біполярної манії була зміна загального балу за шкалою YMRS (оціночна шкала маній Янга) від вихідного рівня до тижня 3; показник за шкалою PANSS також застосовувався як додатковий результат ефективності в кожному дослідженні.
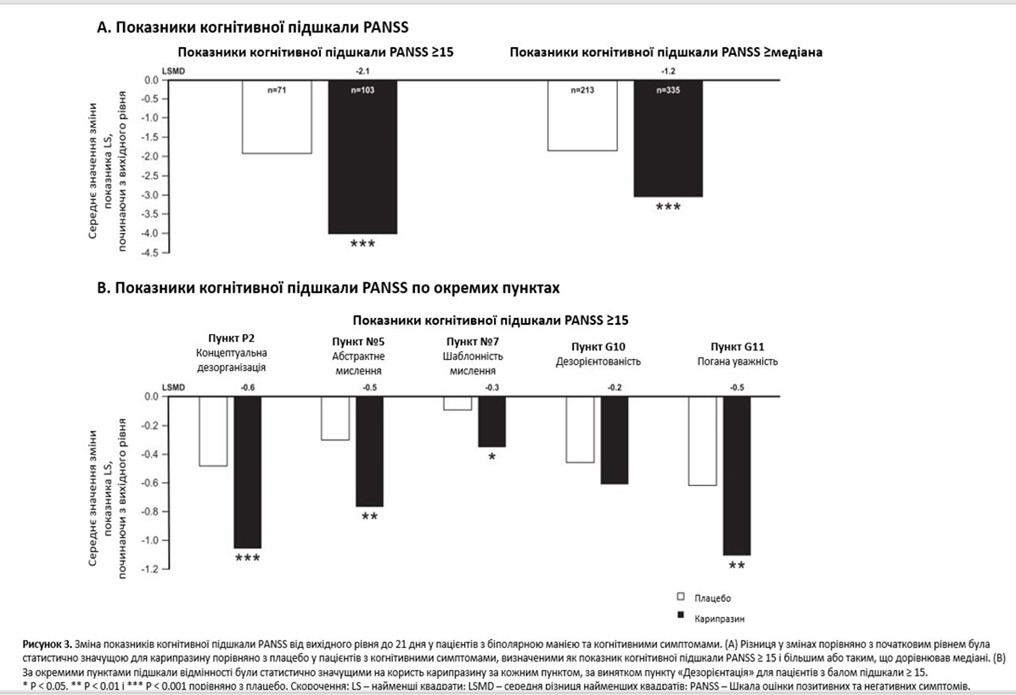
Під час ретроспективних аналізів оцінювалися зміни від вихідного рівня до 21-го дня в балах когнітивної підшкали PANSS, балах окремих елементів когнітивної підшкали PANSS і загальному балі YMRS. Пункти когнітивної підшкали PANSS: P2 (концептуальна дезорганізація), N5 (труднощі в абстрактному мисленні), N7 (стереотипне мислення), G10 (дезорієнтація) і G11 (погана увага), з балами в діапазоні від 1 (відсутній) до 7 (максимальний ступінь прояву). Результати оцінювали в популяції mITT і в підгрупі пацієнтів із вираженими когнітивними симптомами, визначеними як когнітивна підшкала PANSS ≥ 15 (що представляє середній бал 3 [легкий ступінь тяжкості] за кожним пунктом 5-пунктової підшкали). Зміни від вихідного рівня також були оцінені в менш обмеженій підгрупі, до якої були включені пацієнти з базовим балом когнітивної підшкали PANSS, вищим або рівним медіані (медіана = 11).
Шизофренія
Були попередньо проаналізовані та визначені результати вивчення когнітивних симптомів у всіх трьох ключових шеститижневих дослідженнях карипразину у дорослих пацієнтів із загостренням шизофренії та в 26-тижневому дослідженні у пацієнтів із шизофренією і переважаючими негативними симптомами. Щоб об’єктивно оцінити вплив карипразину на когнітивні симптоми при шизофренії, було вивчено результат, заснований на результативності, з серії тестів для визначення уваги системи Cognitive Drug Research (CDR), яка була додатковим параметром ефективності в основному дослідженні RGH-MD-04 (NCT01104766). Серія тестів для визначення уваги системи CDR складається із трьох коротких і високочутливих тестів (час простої реакції, цифрова пильність і час реакції вибору), згрупованих у фактори; були зареєстровані фактори сили уваги (СУ) і безперервності уваги (БУ). У дослідженні RGH-MD-04 пацієнти з поточним психотичним епізодом тривалістю < 2 тижнів були рандомізовані (1:1:1:1) для отримання плацебо, карипразину 3 мг/добу, карипразину 6 мг/добу або арипіпразолу 10 мг /добу (включено для визначення чутливості аналізу).
Статистичні аналізи
Зміни в оцінках MADRS, PANSS і FAST були проаналізовані за допомогою моделі змішаних ефектів для повторних вимірювань із неструктурованою коваріаційною матрицею, включаючи дослідження, базову оцінку, лікування, відвідування та взаємодію лікування за візитом і взаємодію базового рівня за візитом як коваріати. Усі статистичні тести були двосторонніми і мали 5% рівень значущості. Значення P не були скориговані для багаторазових порівнянь. Медіанні зміни та значення P для результатів серії тестів для визначення уваги системи CDR були проаналізовані за допомогою тесту суми рангів Вілкоксона, заснованого на використанні останнього задокументованого значення.
Результати
Розподіл учасників клінічного дослідження
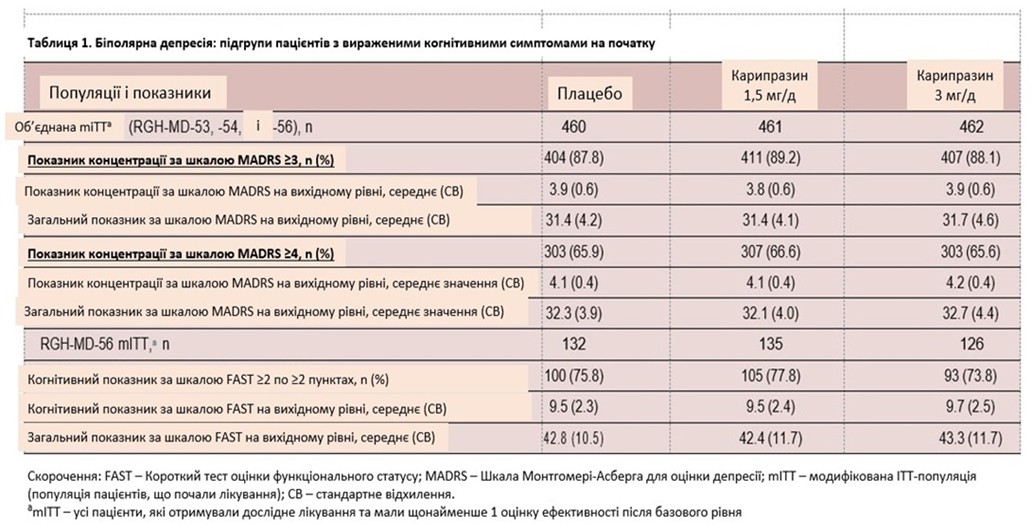
Загалом у дослідженнях брали участь 1383 пацієнти в об’єднаній популяції біполярної депресії mITT (таблиця 1). На початковому етапі 88,4% пацієнтів мали щонайменше легкі когнітивні симптоми (бал за пунктом 6 MADRS ≥ 3) і 66,0% мали щонайменше помірні когнітивні симптоми (бал за пунктом 6 MADRS ≥ 4); базовий рівень MADRS, пункт 6, і загальні бали були подібними в групах, які отримували плацебо та карипразин. У дослідженні RGH-MD-56 393 пацієнти мали базові та постбазові показники FAST і були включені до популяції mITT. Середній вихідний загальний бал FAST у популяції mITT становив 38,8, що вказує на популяцію з помірними та важкими функціональними порушеннями. Загалом 75,8% пацієнтів мали базові когнітивні симптоми (когнітивний бал FAST ≥ 2 принаймні по 2 із 5 пунктів; таблиця 1).
Зміни в когнітивних і депресивних симптомах: шкала MADRS, пункт 6 і загальний бал
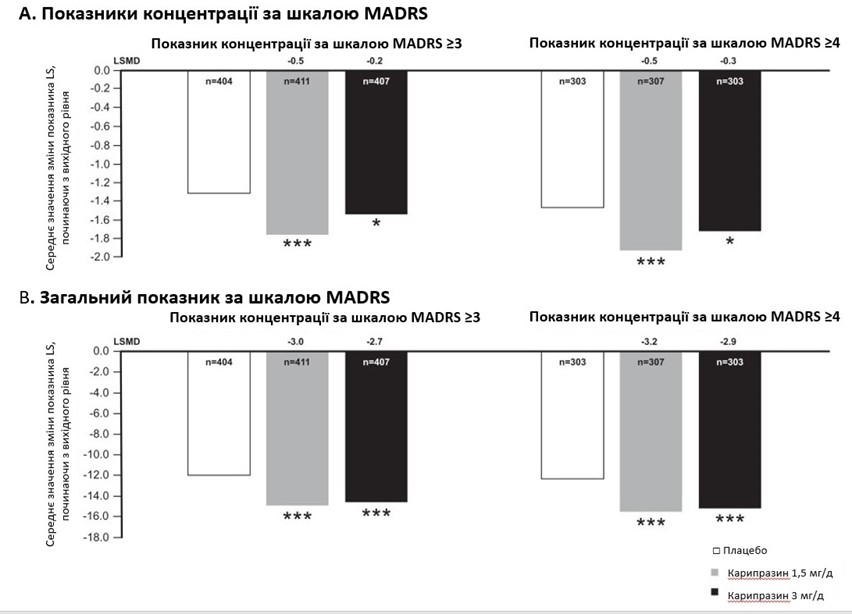
У об’єднаній популяції mITT середня зміна найменших квадратів (LS) від вихідного рівня до шостого тижня в пункті концентрації MADRS (пункт 6) становила –1,2 для плацебо, –1,6 для карипразину 1,5 мг/добу та –1,4 для карипразину 3 мг/добу. Відмінності, порівняно з плацебо, були статистично значущими для карипразину 1,5 мг/добу (P < 0,0001) і 3 мг/добу (P = 0,0365). Різниця в середній зміні від вихідного рівня в пункті 6 MADRS була статистично значущою для карипразину 1,5 і 3 мг/добу, порівняно з плацебо, у пацієнтів із принаймні легкими когнітивними симптомами (бал за пунктом 6 ≥ 3) і принаймні помірними когнітивними симптомами (бал за пунктом 6 ≥ 4; рисунок 1A). У пацієнтів із принаймні легкими когнітивними симптомами середня зміна LS від вихідного рівня до шостого тижня становила –1,3 для плацебо, –1,8 для дози –1,5 мг/добу (P < 0,0001) і –1,5 для 3 мг/добу (P = 0,0292); у пацієнтів із принаймні помірними когнітивними симптомами середня зміна LS становила –1,5 для плацебо, –1,9 для дози 1,5 мг/день (P < 0,0001) і –1,7 для дози 3 мг/день(P = 0,0366).Text
Різниця в середній зміні загального балу MADRS (симптоми депресії), порівняно з вихідним показником, була статистично значущою на користь карипразину, порівняно з плацебо, для пацієнтів із принаймні легкими когнітивними симптомами та принаймні помірними когнітивними симптомами (рисунок 1B). Середня зміна LS у загальному балі MADRS становила –12,0 для плацебо, –15,1 для карипразину у дозі 1,5 мг/день (P < 0,0001) і –14,7 для дози 3 мг/день (P = 0,0001) у пацієнтів із принаймні легкими когнітивними симптомами та –12,3 для плацебо, –15,6 для дози 1,5 мг/день (P < 0,0001) і –15,2 для дози 3 мг/день (P < 0,0006) у пацієнтів із принаймні помірними когнітивними симптомами.
Рисунок 1. Зміни показників MADRS від вихідного рівня до шостого тижня у пацієнтів із біполярною депресією та когнітивними симптомами. Відмінності у змінах від вихідного рівня за пунктом (А) Концентрація за шкалою MADRS і (В) Загальний показник за шкалою MADRS були статистично значущими на користь карипразину 1,5 і 3 мг/добу, порівняно з плацебо, для пацієнтів у підгрупах з вищими та нижчими когнітивними симптомами.
*P < 0,05 і ***P < 0,001, порівняно з плацебо.
Скорочення: LS – найменші квадрати; MADRS – Шкала Монтгомері – Асберга для оцінки депресії.
Зміни у функціонуванні: показники Когнітивної підшкали FAST, оцінка за пунктами підшкали і загальна оцінка
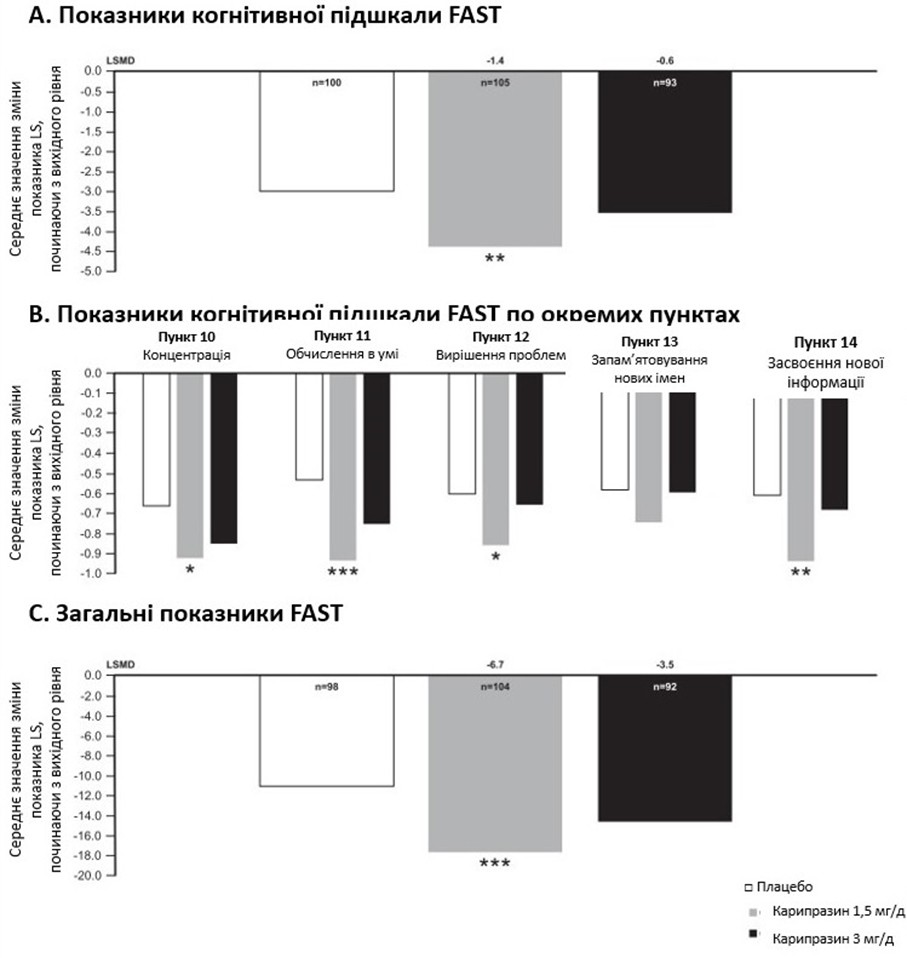
У загальній популяції ITT різниця у змінах від вихідного рівня до восьмого тижня в балах когнітивної підшкали FAST була статистично значущою на користь карипразину у дозі 1,5 мг/добу, порівняно з плацебо (LSMD = 1,2; P = 0,0035); різниця для карипразину 3 мг/добу проти плацебо не була статистично значущою (LSMD = –0,5). У пацієнтів із початковими когнітивними симптомами (бали ≥ 2 принаймні за 2 із 5 пунктів когнітивної підшкали FAST) різниця у змінах від вихідного рівня в балах когнітивної підшкали FAST була статистично значущою на користь карипразину 1,5 мг/добу, порівняно з плацебо (LSMD = –1,4; P = 0,0039); різниця для карипразину у дозі 3 мг/добу проти плацебо не була статистично значущою (LSMD = –0,6; рисунок 2А). Також слід зазначити, що зміни, порівняно з вихідним рівнем, суттєво відрізнялися на користь карипразину 1,5 мг/добу, порівняно з плацебо, за 4 із 5 окремих симптомів, включених у когнітивну підшкалу FAST (тобто концентрація, розумові обчислення, вирішення проблем та вивчення нової інформації); для карипразину не спостерігалося статистично значущих відмінностей порівняно з плацебо 1,5 мг/день для пункту «Запам’ятовування нових імен» або для карипразину 3 мг/день для будь-якого пункту (рисунок 2B). У підгрупі пацієнтів із початковими когнітивними симптомами різниця у зміні загального балу FAST від вихідного рівня також була статистично значущою для карипразину 1,5 мг/добу (LSMD = –6,7; P = 0,0009), порівняно з плацебо, що свідчить про загальне покращення функціональності в цій групі; результати приймання карипразину у дозі 3 мг/добу істотно не відрізнялися від плацебо (LSMD = –3,5; рисунок 2C).
Рисунок 2. Зміни показників шкали FAST від вихідного рівня до восьмого тижня у пацієнтів із біполярною депресією та когнітивними симптомами (когнітивна підшкала FAST ≥ 2 у принаймні 2 із 5 пунктів). (A) Різниця у змінах від вихідного рівня за когнітивною підшкалою FAST значно відрізнялася для карипразину 1,5 мг/добу, порівняно з плацебо. (B) Зміни від вихідного рівня в балах за окремими пунктами FAST суттєво відрізнялися для карипразину 1,5 мг/день, порівняно з плацебо, за всіма пунктами, крім пункту «Пам’ять». (C) Зміна загального показника FAST, порівняно з вихідним рівнем, значно відрізнялася від плацебо для карипразину 1,5 мг/добу.
*P < 0,05, **P < 0,01 і ***P < 0,001, порівняно з плацебо.
Скорочення: FAST – Короткий тест оцінки функціонального статусу; LS – найменші квадрати.
Біполярна манія
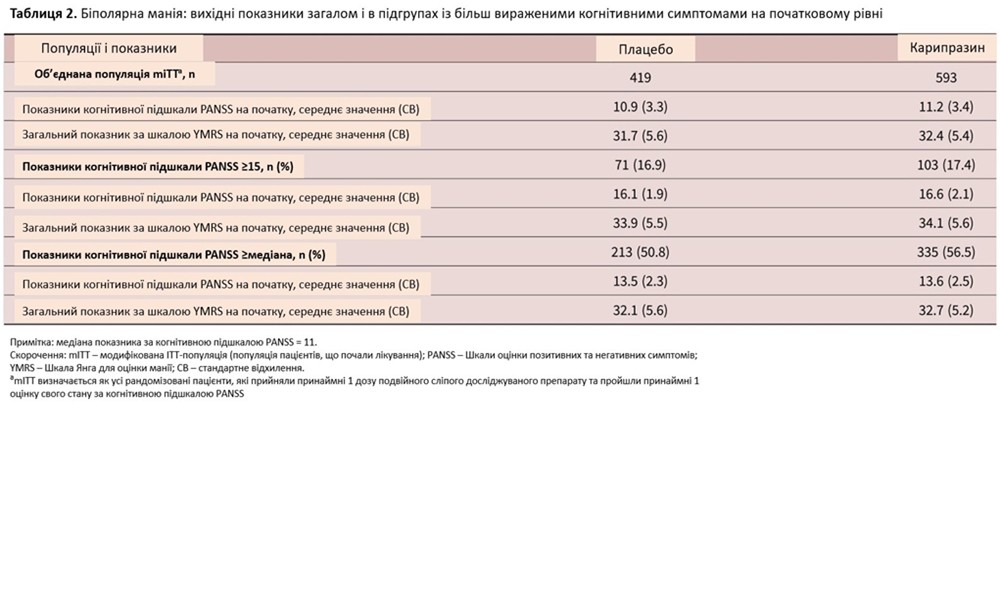
Загалом було 1012 пацієнтів у об’єднаній популяції біполярної манії mITT (таблиця 2). У популяції mITT базові оцінки Шкали оцінки позитивних та негативних симптомів PANSS та загальні оцінки за шкалою YMRS були подібними в групах карипразину та плацебо. Подібні оцінки когнітивної підшкали PANSS та загальні оцінки YMRS для карипразину та плацебо також були визначені на початковому рівні в підгрупі з показником когнітивної підшкали PANSS ≥ 15 і в підгрупі з базовою оцінкою когнітивної підшкали PANSS на рівні медіани або вище (таблиця 2). Більше половини всіх пацієнтів мали вихідну оцінку когнітивної підшкали PANSS на рівні або вище медіани (11), тоді як 17,2% пацієнтів мали показник когнітивної підшкали PANSS ≥ 15 (таблиця 2).
У об’єднаній популяції mITT середня зміна від вихідного рівня до 21-го дня за когнітивною підшкалою PANSS становила –2,2 для карипразину та –1,3 для плацебо, зі статистично значущим показником LSMD на користь карипразину, порівняно з плацебо (–0,9; P < 0,0001). У пацієнтів із показником когнітивної підшкали PANSS ≥ 15 різниця у змінах від вихідного рівня до 21 дня була статистично значущою на користь карипразину проти плацебо (P = 0,0002); у пацієнтів із показником когнітивної підшкали PANSS, вищим за медіану, знову була відзначена статистично значуща різниця на користь карипразину, порівняно з плацебо (P < 0,0001; рисунок 3A). А у пацієнтів із показником когнітивної підшкали PANSS ≥ 15 зміни від вихідного рівня до 21 дня значно відрізнялися на користь карипразину та плацебо за всіма окремими пунктами когнітивної підшкали PANSS, за винятком пункту «Дезорієнтація» (рисунок 3B). Для пацієнтів із початковим показником когнітивної підшкали PANSS на рівні або вище медіани LSMD також були статистично значущими на користь карипразину за 4 із 5 пунктів (P2: –0,4, P < 0,0001; N5: –0,2, P = 0,0127; N7: –0,1, P = 0,1246; G10: –0,1, P = 0,0392; G11: –0,3, P = 0,0002). На відміну від підгрупи з базовим показником когнітивної підшкали PANSS ≥ 15, різниця за пунктом N7 не була статистично значущою, хоча різниця за пунктом G10 була статистично значущою (дані не показані).
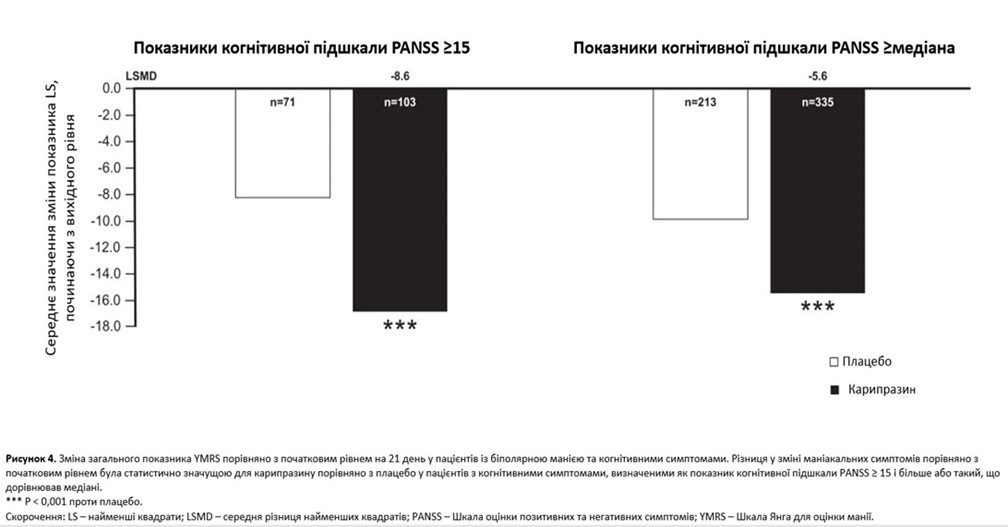
Різниця в середній зміні маніакальних симптомів від вихідного рівня до 21-го дня була статистично значущою на користь карипразину, порівняно з плацебо, в підгрупі пацієнтів із базовим балом за когнітивною підшкалою PANSS ≥ 15 (LSMD = –8,6; P < 0,0001); дещо менша, але статистично значуща середня різниця була також відзначена для карипразину проти плацебо в підгрупі з вихідними показниками когнітивної підшкали PANSS на рівні або вище медіани (LSMD = –5,6; P < 0,0001; рисунок 4).
Шизофренія
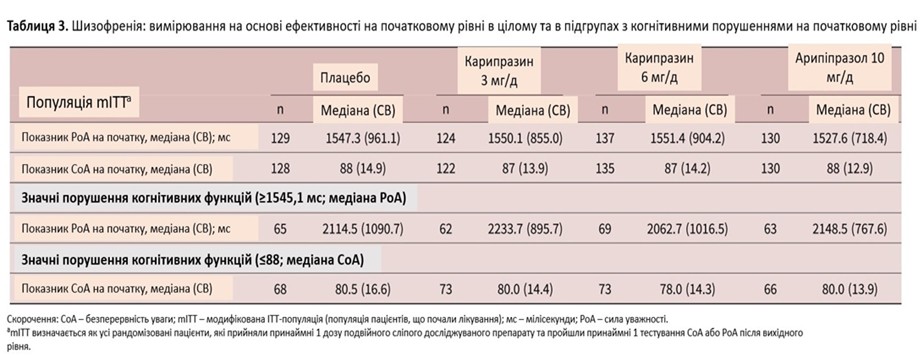
Загалом 520 пацієнтів були включені в дослідження mITT шизофренії RGH-MD-04 (таблиця 3). Підгрупи з високим когнітивним порушенням включали пацієнтів із балами, вищими або рівними медіані часу PoA (PoA – сила уважності) (≥ 1545,1 мс) і нижчими або рівними середньому показнику CoA (≤ 88) (CoA – безперервність уваги).
Зміни в показниках ефективності пізнання: потужність уваги та безперервність уваги, визначені системою CDR*
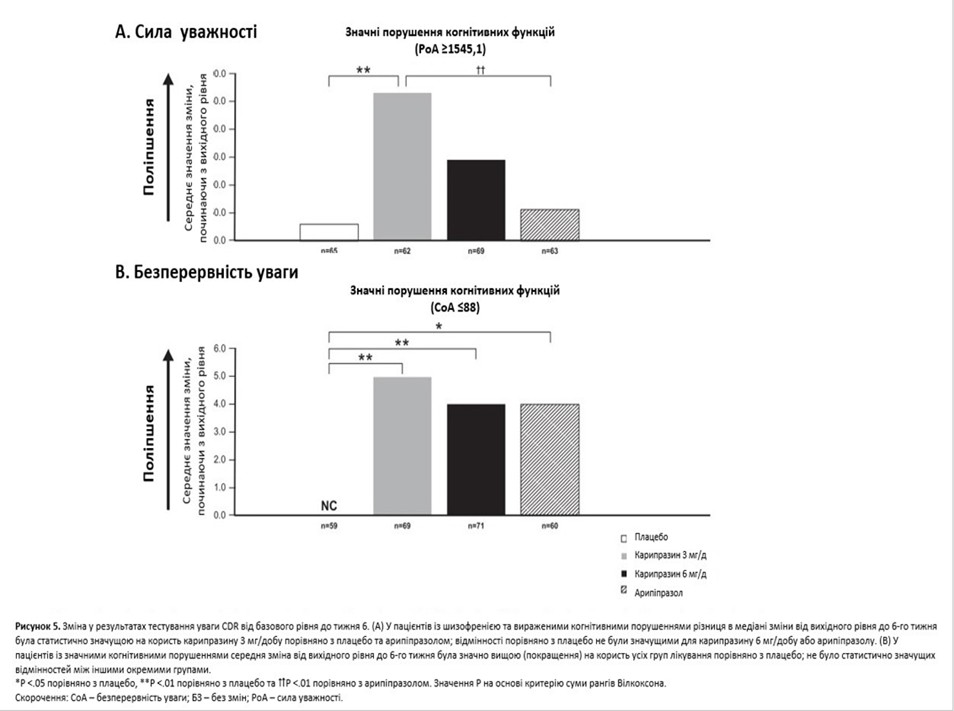
У популяції mITT середнє відхилення (СВ) від вихідного рівня до тижня 6 у PoA (мс) становила 27,3 (597,5) для плацебо, –59 (595,1; P = 0,0036) для карипразину у дозі 3 мг/добу, 5,7 (781,8; P = 0,1272) для карипразину у дозі 6 мг/добу та 44,2 (828,1; P = 0,4104) для арипіпразолу 10 мг/добу. Відмінності, порівняно з плацебо, були статистично значущими для карипразину 3 мг/день, але не для карипразину 6 мг/день або арипіпразолу (значення P на основі суми рангів Вілкоксона). Відмінності у зміні PoA також були статистично значущими для обох доз карипразину, порівняно з арипіпразолом (карипразин 3 мг/добу, P = 0,0006; карипразин 6 мг/добу P = 0,0260). У пацієнтів із показником PoA, вищим або рівним медіані PoA на початку (високі когнітивні порушення), різниця в медіані зміни від базового рівня до шостого тижня була статистично значущою на користь карипразину 3 мг/добу, порівняно з плацебо (P = 0,0080) і порівняно з арипіпразолом (P = 0,0064). Відмінності, порівняно з плацебо, не були значущими для карипразину 6 мг/добу (P = 0,2974) або арипіпразолу (P = 0,4443; рисунок 5A).
Для оцінки показника CoA в популяції mITT середня зміна (СЗ) від вихідного рівня до тижня 6 становила 0 (11,7) для плацебо, 2 (10,5; P = 0,0005) для карипразину у дозі 3 мг/день, 1 (14,1; P = 0,168) для карипразину 6 мг/добу та 0 (13,9; P = 0,1685) для арипіпразолу 10 мг/добу. Відмінності, порівняно з плацебо, були статистично значущими для карипразину 3 та 6 мг/добу, але не для арипіпразолу 10 мг/добу. У пацієнтів із показником CoA, нижчим або таким, що дорівнював медіані CoA на початковому рівні (більше когнітивних порушень), середня зміна від вихідного рівня до шостого тижня була значно вищою, що вказує на покращення, на користь усіх груп лікування, порівняно з плацебо (карипразин 3 мг/добу, P = 0,0012; карипразин 6 мг/добу, P = 0,0073; арипіпразол P = 0,0160). Інших статистично значущих відмінностей між іншими окремими групами не було (рисунок 5B).
*CDR – Клінічна рейтингова шкала деменції.
Обговорення результатів
У процесі численних ретроспективних аналізів, проведених для оцінки впливу карипразину на когнітивні симптоми, було виявлене більше покращення в низці результатів для пацієнтів із біполярним розладом типу I (депресивні та маніакальні епізоди) та шизофренією, які отримували карипразин. Ці репрезентативні результати підтверджують попередні докази покращення когнітивних порушень, продемонстровані на тваринних моделях, і свідчать про потенційну роль карипразину в лікуванні когнітивних симптомів за різними показаннями. Враховуючи, що когнітивна дисфункція при серйозних психічних захворюваннях пов’язана зі зниженням якості життя і гіршими функціональними результатами, когнітивні симптоми слід розглядати як критичну клінічну та терапевтичну мішень для пацієнтів із шизофренією та біполярним розладом I типу.
У пацієнтів із біполярним розладом структура когнітивних порушень є широкою та гетерогенною, з доказами того, що когнітивні симптоми та депресія можуть посилювати одне одного, спричиняючи інвалідизацію. У пацієнтів із біполярним розладом структура когнітивних порушень є широкою та гетерогенною, з доказами того, що когнітивні симптоми та депресія можуть посилювати одне одного, спричиняючи інвалідизацію. Під час цих об’єднаних ретроспективних аналізів даних пацієнтів із біполярною депресією було виявлене більше покращення для карипразину, порівняно з плацебо, щодо показників когнітивних функцій, депресії та функціонування в загальній популяції та в підгрупах пацієнтів із вираженими когнітивними симптомами. Оскільки дані вказують на розрив між клінічними результатами та функціональним відновленням у пацієнтів із біполярним розладом, виявлення того, що карипразин 1,5 мг/добу покращує когнітивні та депресивні симптоми, а також функціонування у пацієнтів з біполярною депресією, є цікавим клінічним результатом. Крім того, у пацієнтів з епізодами маніакального або змішаного біполярного розладу типу I та початковими когнітивними симптомами спостерігалося значне покращення когнітивних симптомів при застосуванні карипразину, порівняно з плацебо (тобто зміна порівняно з вихідним рівнем у когнітивній підшкалі PANSS та по 4 із 5 окремих пунктів підшкали), як і при маніакальних симптомах (тобто зміна загального показника YMRS). Це демонструє, що ефективність лікування маніакальних симптомів не була під загрозою через наявність базових когнітивних симптомів.
Нейрокогнітивний профіль пацієнтів із шизофренією характеризується дефіцитом у численних когнітивних сферах, що супроводжує загальні інтелектуальні порушення, які можуть передувати появі захворювання. Для доповнення раніше опублікованих висновків щодо суб’єктивних когнітивних результатів у пацієнтів із шизофренією, які отримували карипразин, було проведено ретроспективний аналіз даних карипразину RGH-MD-04, ключового дослідження, під час якого використовувалася комп’ютеризована, заснована на ефективності батарея тестів на увагу (система CDR). Коли фактор PoA, результат вимірювання концентрованої уваги, і фактор CoA, результат вимірювання стійкості уваги, були проаналізовані в загальній популяції ITT, різниця з плацебо була значною для карипразину 3 мг/день (P = 0,0036), але не для карипразину 6 мг/добу або для арипіпразолу. При проведенні аналізу показників PoA у пацієнтів із вихідним порушенням уваги було знову відзначено значно більшу середню зміну PoA від вихідного рівня для карипразину 3 мг/добу, порівняно з плацебо, а також для карипразину 3 мг/добу, порівняно з активним препаратом порівняння арипіпразолом. Оскільки показники швидкості завдань на концентрацію уваги PoA відображають інтенсивність концентрації в цей конкретний момент, швидші відповіді вказують на те, що використовувалося більше когнітивних процесів і високий рівень концентрації. При дослідженні фактора CoA було виявлено значно більшу середню зміну, порівняно з вихідним рівнем для карипразину 3 і 6 мг/добу, порівняно з плацебо. CoA відображає здатність підтримувати концентрацію, причому більша зміна, порівняно з початковим рівнем, свідчить про те, що пацієнти, які отримували карипразин, змогли зосередитися на одному завданні протягом тривалішого періоду, ніж пацієнти, які отримували плацебо. Слід зазначити, що ці результати підтверджують попередні докази покращення когнітивних симптомів, отримані у дослідженні RGH-MD-04, і це було продемонстровано статистично значущими відмінностями на користь карипразину 3 та 6 мг/добу, порівняно з плацебо (P < 0,001 обидві дози), у змінах від базового рівня, визначених за когнітивною підшкалою PANSS33.
У той час як ці результати аналізу з використанням системних факторів CDR забезпечують об’єктивну оцінку уваги в одному дослідженні шизофренії, додаткові докази ефекту лікування карипразином щодо когнітивних симптомів були запропоновані в об’єднаних ретроспективних аналізах даних основних досліджень у пацієнтів із гострим загостренням шизофренії. Зокрема, було відзначено статистично значуще покращення для карипразину у дозах від 1,5 до 9 мг/добу, порівняно з плацебо, в змінах від вихідного рівня до шостого тижня за різними результатами, включаючи когнітивну підшкалу PANSS (LSMD = –1,47; P < 0,001), кожен окремий пункт когнітивної підшкали PANSS (P < 0,001 кожен елемент) і фактор розладу мислення PANSS (LSMD = –2,0; розмір ефекту = 0,47; P < 0,0001). Фактор розладу мислення PANSS із 6 пунктів складається з таких пунктів як «Труднощі з абстрактним мисленням», «Манірність та порушення пози тіла», «Погана увага», «Порушення волі», «Завантаженість психічними переживаннями» і «Концептуальна дезорганізація». Додаткові докази покращення когнітивних симптомів завдяки карипразину також спостерігались у 26-тижневому дослідженні пацієнтів із шизофренією та постійними переважаючими негативними симптомами. Варто відзначити, що відмінності у змінах від вихідного рівня були статистично значущими для карипразину 4,5 мг/добу проти рисперидону 4 мг/добу (активний препарат порівняння) як за когнітивною підшкалою PANSS (LSMD = –0,53; P = 0,028), так і за фактором розладу мислення PANSS (LSMD = –0,63; P = 0,05). Оскільки тяжкість когнітивної дисфункції була пов’язана з психозом, а також із негативними симптомами у пацієнтів з шизофренією та біполярним розладом, сприятливі результати приймання карипразину щодо когнітивних симптомів у пацієнтів із задокументованими негативними симптомами можуть мати особливий інтерес.
Хоча доступні на даний момент лікарські засоби можуть ефективно лікувати депресивні та маніакальні симптоми біполярного розладу I та психози при шизофренії, докази ефективності лікування когнітивних симптомів, пов’язаних із захворюванням, обмежені, і на сьогоднішній день не існує надійно визначеного фармакологічного лікування когнітивних порушень. Окрім карипразину, доклінічні та клінічні дослідження кількох інших новітніх атипових антипсихотичних засобів (наприклад, луразидон, брекспіпразол та люматеперон) продемонстрували прокогнітивні властивості, які, ймовірно, пов’язані з їхніми дофамінергічними механізмами. Систематичний огляд досліджень щодо покращення когнітивних функцій за допомогою нових фармакологічних засобів (наприклад, міфепристону, галантаміну та донепезилу) при біполярному розладі дав невтішні або попередні результати без переконливих ефектів. Крім того, оскільки когнітивні труднощі можуть зберігатися протягом періодів ейтимії у пацієнтів з біполярним розладом I, цікаво відзначити, що додатковий прийом луразидону був ефективнішим, ніж звичайне лікування, у покращенні когнітивних функцій у ейтимічних пацієнтів зі зниженим когнітивним функціонуванням. При шизофренії результати досліджень зміни когнітивного дефіциту у пацієнтів, які отримували атипові антипсихотичні засоби, були неоднозначними; деякі результати свідчать про більший потенціал покращення когнітивних симптомів при застосуванні атипових антипсихотичних засобів, порівняно з традиційними, а інші автори не підтверджують цей висновок. У метааналізі проспективних клінічних досліджень було виявлено, що атипові антипсихотики мають помірний вплив на когнітивний дефіцит при шизофренії, причому конкретні специфічні атипові препарати мають різну ефективність у певних когнітивних областях.
Хоча когнітивний дефіцит є складною проблемою з потенційно гетерогенною етіологією, унікальний механізм дії карипразину може запропонувати переваги в лікуванні когнітивних функцій завдяки його активності на рецепторі дофаміну D3, який був визначений як мішень лікування когнітивних симптомів. На відміну від інших антагоністів або часткових агоністів дофамінових рецепторів D2 і D3, карипразин має більший вплив на рецептор D3, ніж сам дофамін, що призводить до блокади рецептора D3. Маючи майже в 10 разів більшу спорідненість до D3-рецепторів, ніж D2-рецепторів in vitro, карипразин також показує високу спорідненість in vivo як до дофамінових D2-, так і D3-рецепторів у клінічно значущих дозах. У дослідженні на тваринах карипразин продемонстрував залежні від дофаміну D3 прокогнітивні ефекти, що додатково свідчить про його потенційну перевагу ефективності щодо когнітивних симптомів у пацієнтів із серйозними психічними захворюваннями. Також важливо зазначити, що, оскільки у нижчих дозах карипразин має більшу перевагу щодо захоплення рецепторів дофаміну D3, порівняно з рецепторами D2, більший вплив нижчих доз карипразину на когнітивні симптоми як при біполярній депресії, так і при шизофренії в наших поточних аналізах узгоджується з його фармакологічним профілем.
Ці аналізи мають кілька обмежень, включаючи їхній ретроспективний характер і відсутність коригування для кількох порівнянь, що є типовим для post hoc-оцінок. Оскільки ретельні нейропсихологічні оцінки не проводилися, наші висновки слід вважати відповідними для когнітивних симптомів, але не обов’язково для когнітивних дефіцитів або соціального пізнання, які є окремими областями, що зазнають глибоких порушень при біполярному розладі та шизофренії. Оскільки когнітивні функції не були основним результатом у жодному з досліджень, а об’єктивні показники когнітивних здібностей не були включені в більшість випадків, аналіз ґрунтувався на оціночних шкалах оцінки когнітивних функцій, які були включені в протоколи дослідження. Наприклад, пункт 6 MADRS («Концентрація уваги») використовувався в ретроспективному аналізі досліджень біполярної депресії, оскільки концентрація вважається піддоменом когнітивних процесів вищого рівня (тобто виконавчої функції). Оскільки глобальне когнітивне функціонування вимагає координації та ефективного використання компонентів когнітивних функцій, зміна концентрації може вплинути на когнітивні функції, але цей елемент сам по собі не вважається мірою пізнання. Інтерпретація деяких результатів обмежена використанням показників рейтингової шкали, які не були спеціально розроблені для дослідження когнітивних функцій. Крім того, оскільки когнітивні симптоми тісно пов’язані з навантаженнями афективних і психотичних симптомів, важко визначити, чи пов’язані ефекти лікування з покращенням суб’єктивних когнітивних функцій, порівняно із загальним покращенням симптомів. Крім того, не був проведений аналіз сигнальних шляхів, щоб визначити, чи було покращення когнітивних елементів незалежним від покращення інших елементів, і не було зроблено коригування для типових станів біполярного розладу та шизофренії, таких як ожиріння, які можуть вплинути на когнітивні результати. Складові дослідження були короткими за тривалістю. Не було об’єктивного вимірювання, щоб визначити, чи були когнітивні функції під впливом емоцій, чи були незалежними від них, і дослідження не були розроблені для виявлення відмінностей у лікуванні підгруп пацієнтів. Пацієнти повинні були відповідати суворим критеріям включення та виключення, що може обмежити можливість узагальнити ці результати для інших популяцій біполярного розладу I або шизофренії. Хоча такі характеристики пацієнта як вік, стать, вік початку захворювання, кількість афективних або психотичних епізодів, супутні захворювання та супутні ліки можуть впливати на когнітивне функціонування, наші аналізи не контролювали ці змінні. Відмінності в доступних показниках когнітивних здібностей, дозах і визначеннях когнітивних порушень не дозволяли об’єднати дані для різних показань для аналізу. Нарешті, малий розмір вибірки деяких підгруп також може знизити стабільність і достовірність результатів.
Підсумовуючи, варто зазначити, що в цих дослідницьких ретроспективних аналізах пацієнтів з біполярним розладом I та шизофренією карипразин покращував когнітивні симптоми, функціональність та ефективність, порівняно з плацебо. Більше того, більші покращення, порівняно з плацебо, про які раніше повідомлялося щодо первинних результатів у попередніх дослідженнях (манія, виміряна за допомогою шкали YMRS, і депресія, виміряна за допомогою шкали MADRS), також спостерігалися в цих ретроспективних аналізах підгруп пацієнтів із гіршими когнітивними симптомами. Хоча маніакальні та депресивні симптоми, які пов’язані з біполярним розладом I та загостренням шизофренії, можна добре контролювати за допомогою фармакологічних засобів, лікування когнітивних симптомів залишається незадоволеною потребою у пацієнтів із серйозними психічними захворюваннями. Ці аналізи надають попередні докази того, що карипразин може мати потенційні переваги щодо когнітивних симптомів у пацієнтів з біполярним розладом I та шизофренією. Таким чином, існує потреба у проведенні майбутніх проспективно спланованих коротко- та довгострокових досліджень з вивчення карипразину та когнітивних функцій.
Additional information
Data inquiries can be submitted at https://www.allerganclinicaltrials. com/en/patient-data/.
Previous presentations
Presented at the American Psychiatric Association (APA) Annual Meeting, May 18-21, 2019; the American College of Neuropsycho- pharmacology (ACNP) Annual Meeting, December 8-11, 2019; the Neuroscience Education Institute (NEI) Virtual Poster Library, posted online July 2, 2020.
Acknowledgments. Writing and editorial assistance were provided to the authors by Carol Brown, MS, of Prescott Medical Communications Group (Chicago, IL), a contractor of AbbVie. Statistical analysis support was provided by Qing Dong of AbbVie (Madison, NJ).
Financial support. This manuscript was supported by funding from Allergan (prior to its acquisition by AbbVie). The authors had full control of the content and approved the final version. Neither honoraria nor payments were made for authorship.
Disclosures. R.S.M. has received research grant support from CIHR/GACD/ National Natural Science Foundation of China (NSFC); speaker/consultation fees from Lundbeck, Janssen, Alkermes, Mitsubishi Tanabe, Purdue, Pfizer, Otsuka, Takeda, Neurocrine, Sunovion, Bausch Health, Novo Nordisk, Kris Sanofi, Eisai, Intra-Cellular, NewBridge Pharmaceuticals, AbbVie, Atai Life Sciences. Dr. McIntyre is a CEO of Braxia Scientific Corp. D.G.D. is an employee of Signant Health. E.V. has received grants and served as consultant, advisor, or speaker for: AB-Biotics, Abbott, AbbVie, Angelini, AstraZeneca, Bristol-Myers Squibb, Dainippon Sumitomo Pharma, Farmindustria, Ferrer, Forest Research Institute, Gedeon Richter, Glaxo-Smith-Kline, Janssen, Lundbeck, Otsuka, Pfizer, Roche, SAGE, Sanofi-Aventis, Servier, Shire, Sunovion, Takeda, the Brain and Behaviour Foundation, the Generalitat de Catalunya (PERIS), the Spanish Ministry of Science, Innovation and Universities (CIBERSAM), EU Horizon 2020, and the Stanley Medical Research Institute. I.L. is an employee of Gedeon Richter Plc. P.J.G. is an employee of Signant Health. W.R.E. was an employee of AbbVie at the time of the study, and is a shareholder of AbbVie, AstraZeneca, and Eli Lilly. M.D.P. was an employee of AbbVie at the time of the study and may hold stock.
Список використаних джерел
- McIntyre RS, Cha DS, Soczynska JK, et al. Cognitive deficits and functional outcomes in major depressive disorder: determinants, substrates, and treatment interventions. Depress Anxiety. 2013;30(6):515–527.
- Bortolato B, Miskowiak KW, Kohler CA, Vieta E, Carvalho AF. Cognitive dysfunction in bipolar disorder and schizophrenia: a systematic review of meta-analyses. Neuropsychiatr Dis Treat. 2015;11:3111–3125.
- Sole B, Jimenez E, Torrent C, et al. Cognitive impairment in bipolar disorder: treatment and prevention strategies. Int J Neuropsychopharmacol. 2017;20(8):670–680.
- Raffard S, Gely-Nargeot M-C, Capdevielle D, Bayard S, Boulenger J-P. Learning potential and cognitive remediation in schizophrenia. L’Encé- phale. 2009;35:353–360.
- Altshuler LL, Ventura J, van Gorp WG, Green MF, Theberge DC, Mintz J. Neurocognitive function in clinically stable men with bipolar I disorder or schizophrenia and normal control subjects. Biol Psychiatry. 2004;56(8): 560–569.
- Depp CA, Moore DJ, Sitzer D, et al. Neurocognitive impairment in middle- aged and older adults with bipolar disorder: comparison to schizophrenia and normal comparison subjects. J Affect Disord. 2007;101(1–3):201–209.
- Ivleva EI, Morris DW, Osuji J, et al. Cognitive endophenotypes of psychosis within dimension and diagnosis. Psychiatry Res. 2012;196(1):38–44.
- Kuswanto CN, Sum MY, Sim K. Neurocognitive functioning in schizo- phrenia and bipolar disorder: clarifying concepts of diagnostic dichotomy vs. continuum. Front Psychiatry. 2013;4:162.
- Sanchez-Morla EM, Barabash A, Martinez-Vizcaino V, et al. Comparative study of neurocognitive function in euthymic bipolar patients and stabi- lized schizophrenic patients. Psychiatry Res. 2009;169(3):220–228.
- Schretlen DJ, Cascella NG, Meyer SM, et al. Neuropsychological functioning in bipolar disorder and schizophrenia. Biol Psychiatry. 2007;62(2): 179–186.
- Lewandowski KE, Cohen BM, Ongur D. Evolution of neuropsychological dysfunction during the course of schizophrenia and bipolar disorder. Psychol Med. 2011;41(2):225–241.
- Murray RM, Sham P, Van Os J, Zanelli J, Cannon M, McDonald C. A developmental model for similarities and dissimilarities between schizo- phrenia and bipolar disorder. Schizophr Res. 2004;71(2–3):405–416.
- Vohringer PA, Barroilhet SA, Amerio A, et al. Cognitive impairment in bipolar disorder and schizophrenia: a systematic review. Front Psychiatry. 2013;4:87.
- Kuswanto C, Chin R, Sum MY, et al. Shared and divergent neurocognitive impairments in adult patients with schizophrenia and bipolar disorder: whither the evidence? Neurosci Biobehav Rev. 2016;61:66–89.
- Gkintoni E, Pallis EG, Bitsios P, Giakoumaki SG. Neurocognitive perfor- mance, psychopathology and social functioning in individuals at high risk for schizophrenia or psychotic bipolar disorder. J Affect Disord. 2017;208: 512–520.
- Martinez-Aran A, Vieta E. Cognition as a target in schizophrenia, bipolar disorder and depression. Eur Neuropsychopharmacol. 2015;25(2):151–157
- Ashok AH, Marques TR, Jauhar S, et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 2017;22(5):666–679.
- Howes OD, McCutcheon R, Owen MJ, Murray RM. The role of genes, stress, and dopamine in the development of schizophrenia. Biol Psychiatry. 2017;81(1):9–20.
- Backman L, Nyberg L, Lindenberger U, Li SC, Farde L. The correlative triad among aging, dopamine, and cognition: current status and future pros- pects. Neurosci Biobehav Rev. 2006;30(6):791–807.
- Cole DM, Beckmann CF, Searle GE, et al. Orbitofrontal connectivity with resting-state networks is associated with midbrain dopamine D3 receptor availability. Cereb Cortex. 2012;22(12):2784–2793.
- Nakajima S, Gerretsen P, Takeuchi H, et al. The potential role of dopamine D(3) receptor neurotransmission in cognition. Eur Neuropsychopharmacol. 2013;23(8):799–813.
- Stahl SM. Dazzled by the dominions of dopamine: clinical roles of D3, D2, and D1 receptors. CNS Spectr. 2017;22(4):305–311.
- Kiss B, Horvath A, Nemethy Z, et al. Cariprazine (RGH-188), a dopamine D(3) receptor-preferring, D(3)/D(2) dopamine receptor antagonist-partial agonist antipsychotic candidate: in vitro and neurochemical profile. J Pharmacol Exp Ther. 2010;333(1):328–340.
- Girgis RR, Slifstein M, D’Souza D, et al. Preferential binding to dopamine D3 over D2 receptors by cariprazine in patients with schizophrenia using PET with the D3/D2 receptor ligand [(11)C]-( )-PHNO. Psychopharma- cology (Berl). 2016;233(19–20):3503–3512.
- Neill JC, Grayson B, Kiss B, Gyertyan I, Ferguson P, Adham N. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symp- toms in a rodent model of schizophrenia symptomatology. Eur Neuropsy- chopharmacol. 2016;26(1):3–14.
- Zimnisky R, Chang G, Gyertyan I, Kiss B, Adham N, Schmauss C. Car- iprazine, a dopamine D(3)-receptor-preferring partial agonist, blocks phencyclidine-induced impairments of working memory, attention set- shifting, and recognition memory in the mouse. Psychopharmacology (Berl). 2013;226(1):91–100.
- Durgam S, Earley W, Lipschitz A, et al. An 8-week randomized, double- blind, placebo-controlled evaluation of the safety and efficacy of cariprazine in patients with bipolar I depression. Am J Psychiatry. 2016;173(3): 271–281.
- Earley W, Burgess MV, Rekeda L, et al. Cariprazine treatment of bipolar depression: a randomized double-blind placebo-controlled phase 3 study. Am J Psychiatry. 2019;176(6):439–448.
- Earley WR, Burgess MV, Khan B, et al. Efficacy and safety of cariprazine in bipolar I depression: a double-blind, placebo-controlled phase 3 study. Bipolar Disord. 2020;22(4):372.
- Calabrese JR, Keck PE Jr, Starace A, et al. Efficacy and safety of low- and high-dose cariprazine in acute and mixed mania associated with bipolar I disorder: a double-blind, placebo-controlled study. J Clin Psychiatry. 2015; 76(3):284–292.
- Durgam S, Starace A, Li D, et al. The efficacy and tolerability of cariprazine in acute mania associated with bipolar I disorder: a phase II trial. Bipolar Disord. 2015;17(1):63–75.
- Sachs GS, Greenberg WM, Starace A, et al. Cariprazine in the treatment of acute mania in bipolar I disorder: a double-blind, placebo-controlled, phase III trial. J Affect Disord. 2015;174:296–302.
- Durgam S, Cutler AJ, Lu K, et al. Cariprazine in acute exacerbation of schizophrenia: a fixed-dose, phase 3, randomized, double-blind, pla- cebo- and active-controlled trial. J Clin Psychiatry. 2015;76(12): e1574–e1582.
- Durgam S, Starace A, Li D, et al. An evaluation of the safety and efficacy of cariprazine in patients with acute exacerbation of schizophrenia: a phase II, randomized clinical trial. Schizophr Res. 2014;152(2–3): 450–457.
- Kane JM, Zukin S, Wang Y, et al. Efficacy and safety of cariprazine in acute exacerbation of schizophrenia: results from an international, phase III clinical trial. J. Clin Psychopharmacol. 2015;35(4):367–373.
- Fleischhacker W, Galderisi S, Laszlovszky I, et al. The efficacy of cariprazine in negative symptoms of schizophrenia: post hoc analyses of PANSS individual items and PANSS-derived factors. Eur Psychiatry. 2019;58:1–9
- Marder S, Fleischhacker WW, Earley W, et al. Efficacy of cariprazine across symptom domains in patients with acute exacerbation of schizophrenia: pooled analyses from 3 phase II/III studies. Eur Neuropsychopharmacol. 2019;29(1):127–136.
- Vieta E, Durgam S, Lu K, Ruth A, Debelle M, Zukin S. Effect of cariprazine across the symptoms of mania in bipolar I disorder: analyses of pooled data from phase II/III trials. Eur Neuropsychopharmacol. 2015;25(11): 1882–1891.
- Yatham LN, Vieta E, McIntyre RS, Jain R, Patel M, Earley W. Broad efficacy of cariprazine on depressive symptoms in bipolar disorder and the clinical implications. Prim Care Companion CNS Disord. 2020;22(5):e1–e8.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision. Washington, DC: Amer- ican Psychiatric Association; 2000.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition. Arlington, VA: American Psychiatric Association; 2013.
- Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960;23:56–62.
- Guy W. The Clinical Global Impression Severity and Improvement scales. In: ECDEU Assessment Manual for Psychopharmacology. Rockville, MD: National Institute of Mental Health; 1976:218–222. US Department of Health, Education and Welfare publication (ADM) 76-338.
- Young RC, Biggs JT, Ziegler VE, Meyer DA. A rating scale for mania: reliability, validity and sensitivity. Br J Psychiatry. 1978;133:429–435.
- Montgomery SA, Asberg M. A new depression scale designed to be sensitive to change. Br J Psychiatry. 1979;134:382–389.
- Kay SR, Fiszbein A, Opler LA. The Positive and Negative Syndrome Scale (PANSS) for schizophrenia. Schizophr Bull. 1987;13(2):261–276.
- Rosa AR, Sanchez-Moreno J, Martinez-Aran A, et al. Validity and reliabil- ity of the Functioning Assessment Short Test (FAST) in bipolar disorder. Clin Pract Epidemiol Ment Health. 2007;3:5.
- Meltzer HY, Cucchiaro J, Silva R, et al. Lurasidone in the treatment of schizophrenia: a randomized, double-blind, placebo- and olanzapine- controlled study. Am J Psychiatry. 2011;168(9):957–967.
- Simpson PM, Surmon DJ, Wesnes KA, Wilcock GK. The cognitive drug research computerized assessment system for demented patients: a valida- tion study. Int J Geriatr Psychiatry. 1991;6(2):95–102.
- Bonnin CM, Martinez-Aran A, Reinares M, et al. Thresholds for severity, remission and recovery using the Functioning Assessment Short Test (FAST) in bipolar disorder. J Affect Disord. 2018;240:57–62.
- Millan MJ, Agid Y, Brune M, et al. Cognitive dysfunction in psychiatric disorders: characteristics, causes and the quest for improved therapy. Nat Rev Drug Discov. 2012;11(2):141–168.
- Miskowiak KW, Seeberg I, Kjaerstad HL, et al. Affective cognition in bipolar disorder: a systematic review by the ISBD targeting cognition task force. Bipolar Disord. 2019;21(8):686–719.
- Depp CA, Dev S, Eyler LT. Bipolar depression and cognitive impairment: shared mechanisms and new treatment avenues. Psychiatr Clin North Am. 2016;39(1):95–109.
- Martinez-Aran A, Vieta E, Torrent C, et al. Functional outcome in bipolar disorder: the role of clinical and cognitive factors. Bipolar Disord. 2007; 9(1–2):103–113.
- Wesnes K. An automated system for assessing cognitive function in any environment. In: Caldwell JA and Wesensten NJ, eds., Biomonitoring for Physiological and Cognitive Performance During Military Operations. Pro- ceedings of SPIE. Bellingham, WA: SPIE. Vol. 5797; 2005:24–41.
- Fleischhacker WW, Marder S, Lu K, et al. Efficacy of cariprazine versus placebo across schizophrenia symptom domains: pooled Analyses from 3 phase II/III trials. Poster presented at the Annual Meeting of the American Society of Clinical Psychopharmacology, Miami, Florida, June 22- 25, 2015.
- Zhu Y, Womer FY, Leng H, et al. The relationship between cognitive dysfunction and symptom dimensions across schizophrenia, bipolar dis- order, and major depressive disorder. Front Psychiatry. 2019;10:253.
- Corponi F, Fabbri C, Bitter I, et al. Novel antipsychotics specificity profile: a clinically oriented review of lurasidone, brexpiprazole, cariprazine and lumateperone. Eur Neuropsychopharmacol. 2019;29(9):971–985
- Torrisi SA, Laudani S, Contarini G, et al. Dopamine, cognitive impairments and second-generation antipsychotics: from mechanistic advances to more personalized treatments. Pharmaceuticals (Basel). 2020; 13(11):365.
- Miskowiak KW, Carvalho AF, Vieta E, Kessing LV. Cognitive enhancement treatments for bipolar disorder: a systematic review and methodological recommendations. Eur Neuropsychopharmacol. 2016;26(10):1541–1561.
- Yatham LN, Mackala S, Basivireddy J, et al. Lurasidone versus treatment as usual for cognitive impairment in euthymic patients with bipolar I disorder: a randomised, open-label, pilot study. Lancet Psychiatry. 2017;4(3): 208–217.
- Davidson M, Galderisi S, Weiser M, et al. Cognitive effects of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: a randomized, open-label clinical trial (EUFEST). Am J Psychiatry. 2009; 166(6):675–682.
- Woodward ND, Purdon SE, Meltzer HY, Zald DH. A meta-analysis of neuropsychological change to clozapine, olanzapine, quetiapine, and ris- peridone in schizophrenia. Int J Neuropsychopharmacol. 2005;8(3): 457–472.
- Keefe RS, Bilder RM, Davis SM, et al. Neurocognitive effects of antipsy- chotic medications in patients with chronic schizophrenia in the CATIE trial. Arch Gen Psychiatry. 2007;64(6):633–647.
- Joyce JN, Millan MJ. Dopamine D3 receptor antagonists as therapeutic agents. Drug Discov Today. 2005;10(13):917–925.
- Stahl SM. Mechanism of action of cariprazine. CNS Spectr. 2016;21(2): 123–127.
- Gyertyan I, Kiss B, Saghy K, et al. Cariprazine (RGH-188), a potent D3/D2 dopamine receptor partial agonist, binds to dopamine D3 receptors in vivo and shows antipsychotic-like and procognitive effects in rodents. Neuro- chem Int. 2011;59(6):925–935.
- Cigliobianco M, Paoli RA, Caletti E, et al. Possible association between social cognition and metabolic dysfunctions in bipolar disorder and schizo- phrenia: preliminary results. J Affect Disord. 2019;246:828–835.
- Harvey PD. Domains of cognition and their assessment. Dialogues Clin Neurosci. 2019;21(3):227–237.
- Bora E, McIntyre RS, Ozerdem A. Neurocognitive and neuroimaging correlates of obesity and components of metabolic syndrome in bipolar disorder: a systematic review. Psychol Med. 2019;49(5):738–749.
- McIntyre RS, Mansur RB, Lee Y, et al. Adverse effects of obesity on cognitive functions in individuals at ultra high risk for bipolar disorder: results from the global mood and brain science initiative. Bipolar Disord. 2017;19(2):128–134.
- McIntyre RS, Berk M, Brietzke E, et al. Bipolar disorders. Lancet. 2020;396 (10265):1841–1856.