Нейрохімічна основа шизофренії
- Дофамінова теорія шизофренії вважається однією з провідних нейробіологічних гіпотез, які пояснюють етіологію і патогенез шизофренії1,2.
- У патологічному процесі задіяні різні дофамінові рецептори, їх активність у різних зонах головного мозку може відрізнятися: патологічне зниження – в одних відділах, надмірна активація – в інших.
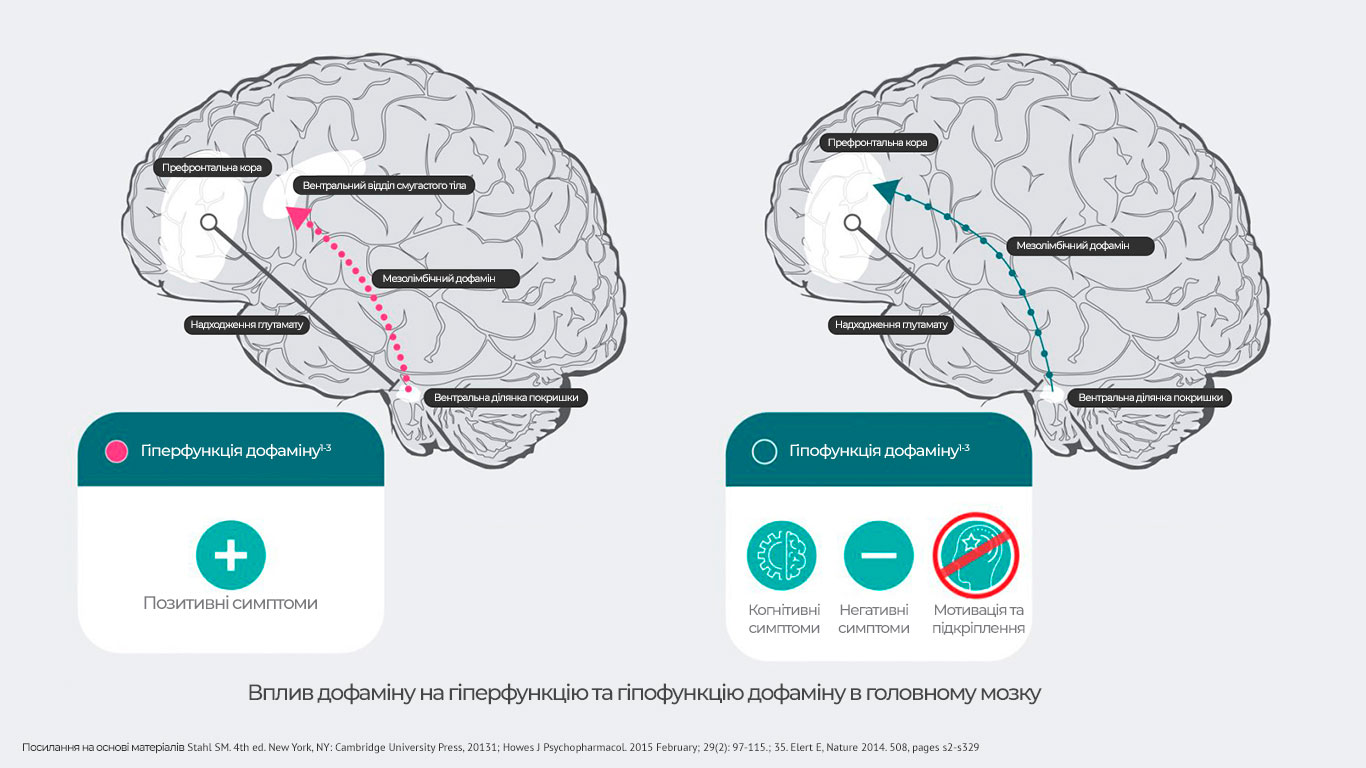
- Вважається, що виникнення позитивних симптомів шизофренії може бути зумовлене гіпердофамінергічним станом у мезолімбічній системі. Поява негативних і когнітивних симптомів шизофренії може бути пов’язана з гіподофамінергічним станом у мезокортикальній системі.
У даному розділі:
Дофамінова теорія
Дана гіпотеза була заснована на непрямих доказах – видимих змінах у стані
пацієнта на тлі лікування антипсихотичними препаратами.
Сучасне уявлення сформувалося в результаті цілеспрямованих клінічних
спостережень, що дозволило краще розібратися в патофізіологічних
механізмах перебігу шизофренії
3.
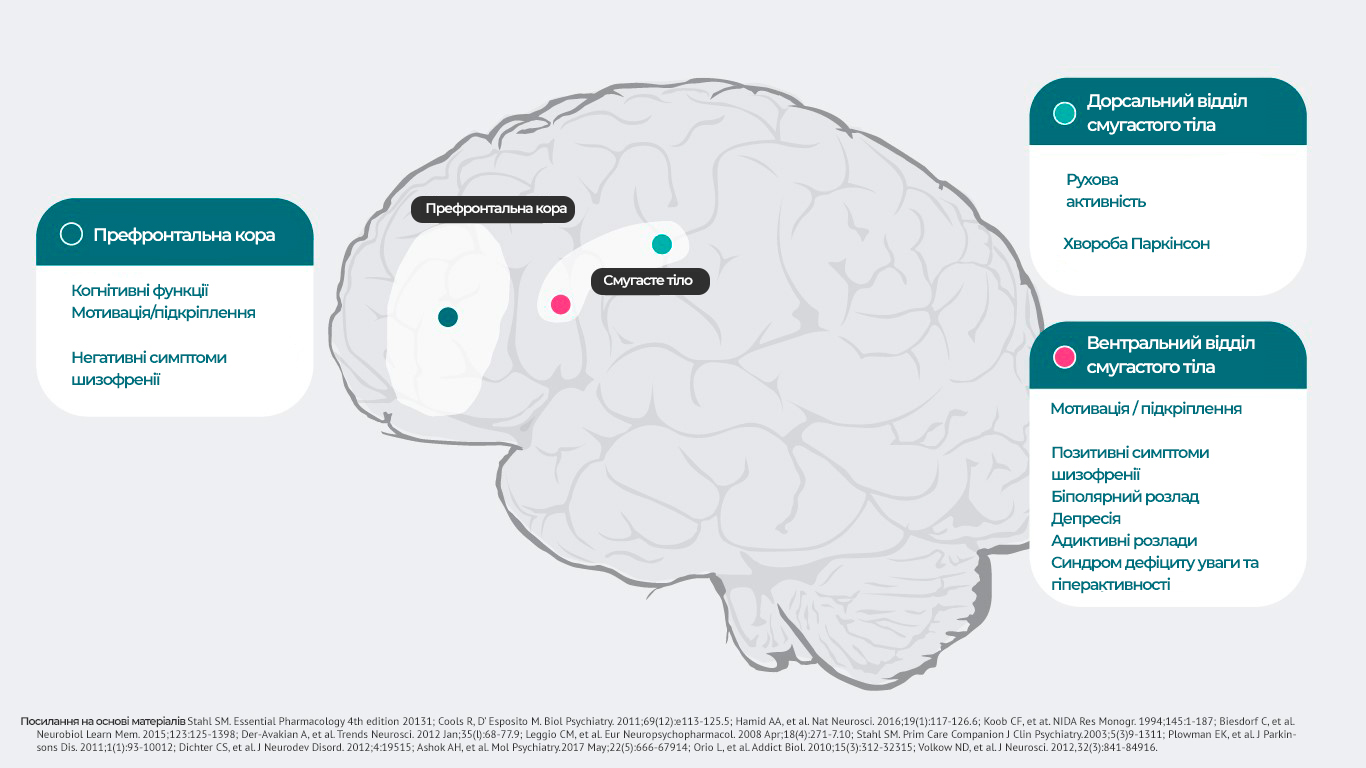
Дофамін та функції головного мозку1,4-16
Дофамін впливає на велику кількість рецепторів, які задіяні в реалізації
психічних та неврологічних функцій. Наприклад, можна виявити наступні
взаємозв’язки.
Ділянка головного мозку – психічні функції та можливі відхилення, які
можуть виникнути:
· префронтальна кора головного мозку – когнітивні функції5, мотиваційна сфера, підкріплення 6–10, негативні симптоми шизофренії 11, дорсальний відділ смугастого тіла – регуляція рухової активності12;
симптоми хвороби Паркінсона 1, дистонія 1;
вентральний відділ смугастого тіла – мотиваційна сфера, підкріплення 6–10, позитивні симптоми шизофренії 11,13, симптоми біполярного розладу 14, депресії8, адиктивні розлади 15,
синдром дефіциту уваги та гіперактивності 16),
Психотропні препарати, які впливають на дофамінові рецептори, можуть
полегшувати симптоми психологічних захворювань.
Необхідне подальше вивчення впливу дофаміну на відділи головного мозку для
кращого розуміння особливостей дії антипсихотичних препаратів у процесі
терапії шизофренії
4.
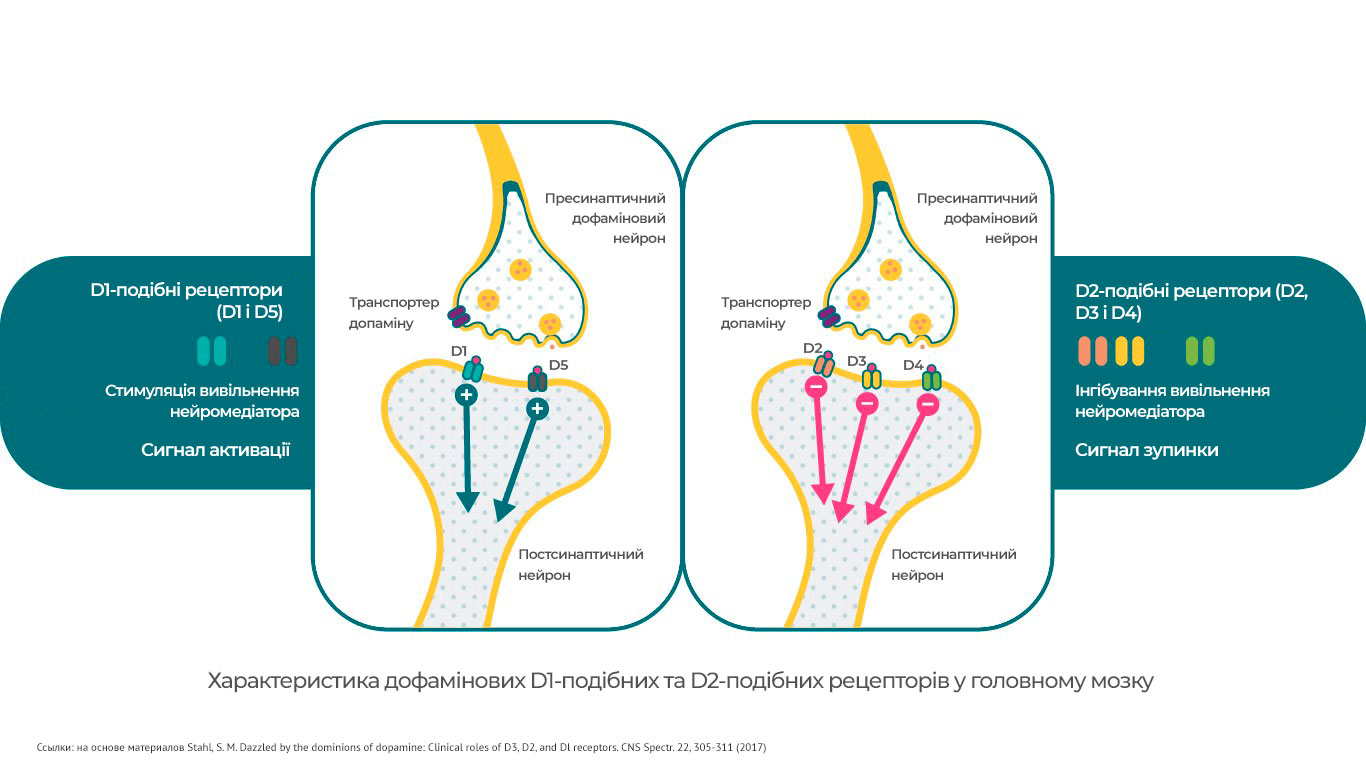
Підтипи дофамінових рецепторів
Існує 5 типів дофамінових рецепторів. Їх можна розділити на 2 основні
групи:
· D1-подібні рецептори. Це D1 і
D5-рецептори.
· D2-подібні рецептори: D2, D3 і
D4-рецептори.
Вважається, що патофізіологічні процеси при шизофренії пов’язані з
D2-, D3– і D1-рецепторами.
Дофамінові рецептори мають різну дію на внутрішньоклітинні сигнали
молекули (вторинні месенджери). Один тип рецепторів здатний загальмувати
проходження імпульсу, інші, навпаки, активувати4. Так,
D1-рецептори стимулюють цАМФ (циклічний аденозинмонофосфат),
D2– і D3-рецептори інгібують цей вторинний
месенджер.
Таким чином, дофамінові D1-, D2– і
D3-рецептори впливають на різні нейробіологічні функції. Це
дозволяє нейромедіатору дофаміну контролювати різні фізіологічні,
поведінкові та патологічні стани
4,17.
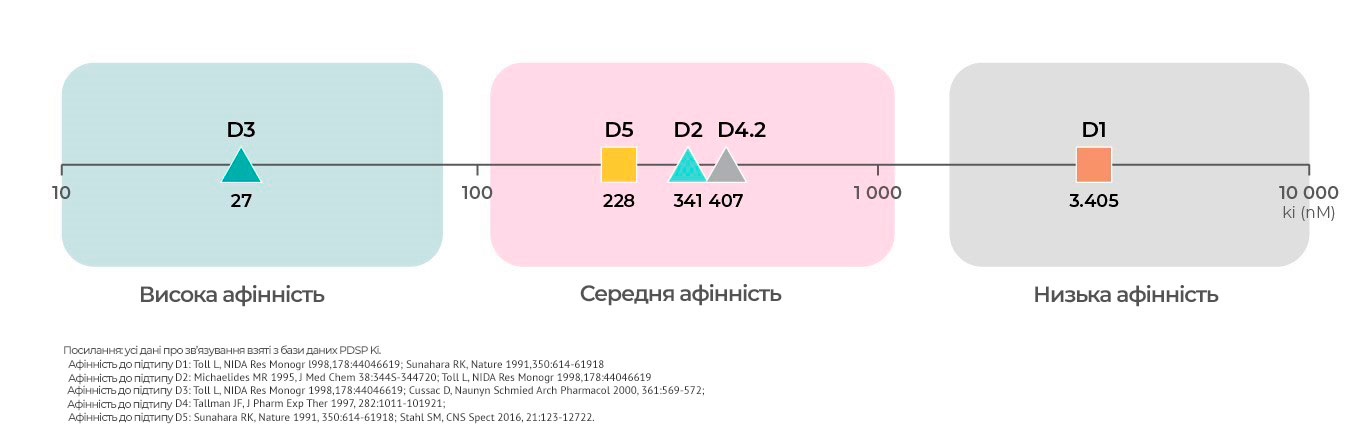
Афінність до дофамінових рецепторів
Кожен підтип дофамінових рецепторів, крім диференційних функцій, має різну
афінність до дофаміну.
Згідно з відомостями, які містяться в базі даних PDSP Ki, найвищу
аффінність мають дофамінові D3-рецептори19 Середню
афінність мають D219,20, D421,
та D5-рецептори.18 Найнижча афінність – у
D1-рецепторів.4,18,19
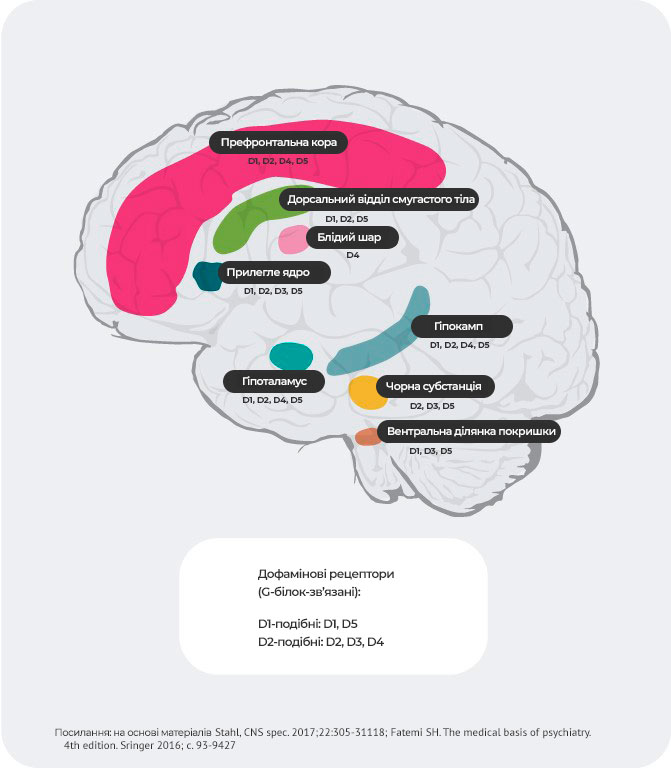
Розподіл дофамінових рецепторів4,22-27
Крім відмінностей в афінності, спостерігається й особливий розподіл
рецепторів, залежно від їх підтипу.
Наприклад, передбачається, що гіперактивне вивільнення дофаміну в
постсинаптичних D2-рецепторах у вентральному відділі смугастого
тіла провокує позитивні симптоми психозу. Як підсумок, дофамінові
D2-рецептори являють собою основну мішень для більшості
антипсихотичних препаратів, які використовуються для лікування
шизофренії.
D3-рецептори виявляються в лімбічній системі, гіпоталамусі та вентральній
ділянці покришки/чорній речовині – ділянках, які, як вважається, беруть
участь у регуляції когнітивних функцій, настрою та мотивації.
У префронтальній корі, де експресія дофамінових D2 і
D3-рецепторів незначна, нейротрансмісія дофаміну суворіше контролюється
постсинаптичними D1-рецепторами.
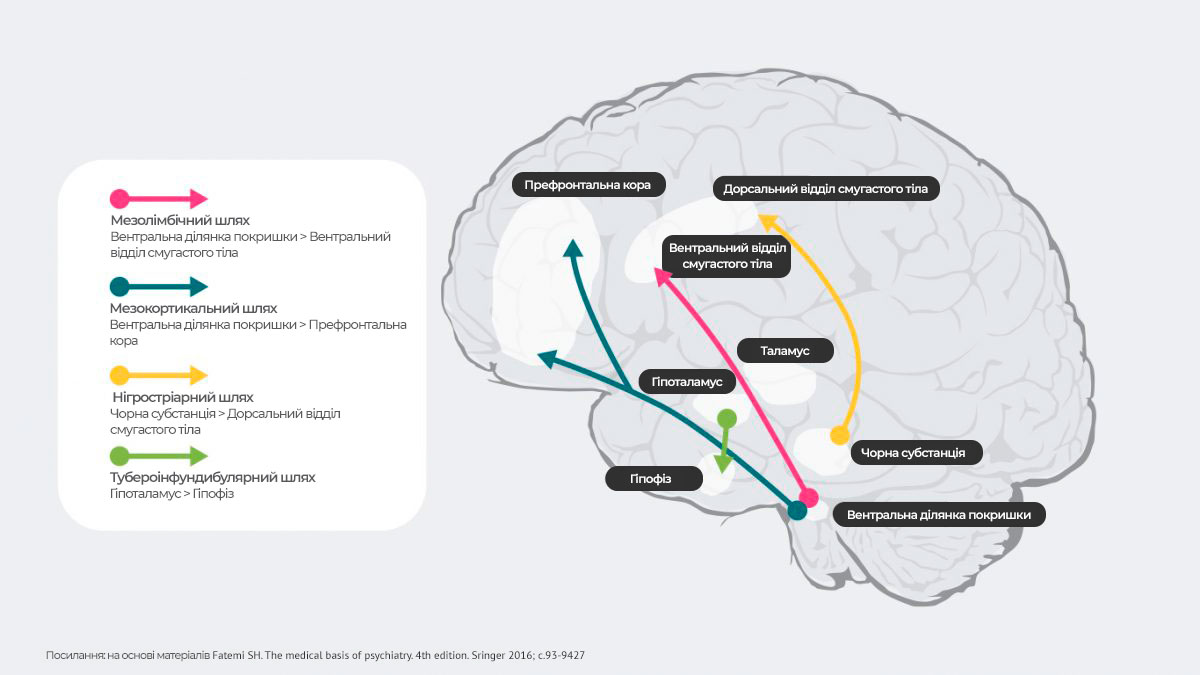
Дофамінергічні шляхи
У головному мозку людини існує 4 основні дофамінергічні шляхи: мезолімбічний, мезокортикальний, нігростріарний та тубероінфундибулярний27:
Мезолімбічний шлях: також відомий як шлях підкріплення, відповідає за передачу дофаміну з вентральної ділянки покришки (ВДП) до вентрального відділу смугастого тіла. Вентральна ділянка покришки розташована в середньому мозку, а вентральний відділ смугастого тіла – у передньому мозку, і включає прилегле ядро та нюховий горбик.
Мезокортикальний шлях: як вважається, бере участь у когнітивних функціях та емоціях, відповідає за передачу дофаміну із вентральної ділянки покришки до префронтальної кори.
Нігростріарний шлях: нігростріарний шлях бере участь у регуляції моторики, відповідає за передачу дофаміну з ділянки чорної субстанції, розташованої в середньому мозку, до хвостатого ядра і базального ядра (путамену), які знаходяться у спинному відділі смугастого тіла.
Тубероінфундибулярний шлях: відповідає за передачу дофаміну з аркуатного ядра медіобазального гіпоталамуса до гіпофіза. Цей шлях регулює секрецію гормонів гіпофіза, в тому числі пролактину.
Дофамін та шизофренія28,29
Дофамінова гіпотеза шизофренії свідчить про те, що гіперактивна
нейротрансмісія дофаміну в підкіркових та лімбічних ділянках головного
мозку пов’язана з позитивними симптомами шизофренії30.
Гіпофункціональність мезокортикальних проекцій дофаміну в префронтальну
кору може більше відповідати за негативні й когнітивні симптоми шизофренії
31,32.
Для пояснення порушень регуляції дофаміну, які можуть лежати в
основі патофізіології шизофренії, було запропоновано кілька
теорій33,34. Так, дослідження виявили, що поява симптомів
хвороби може бути пов’язана з порушенням регуляції глутамату, що
призводить до дофамінергічного дисбалансу35.
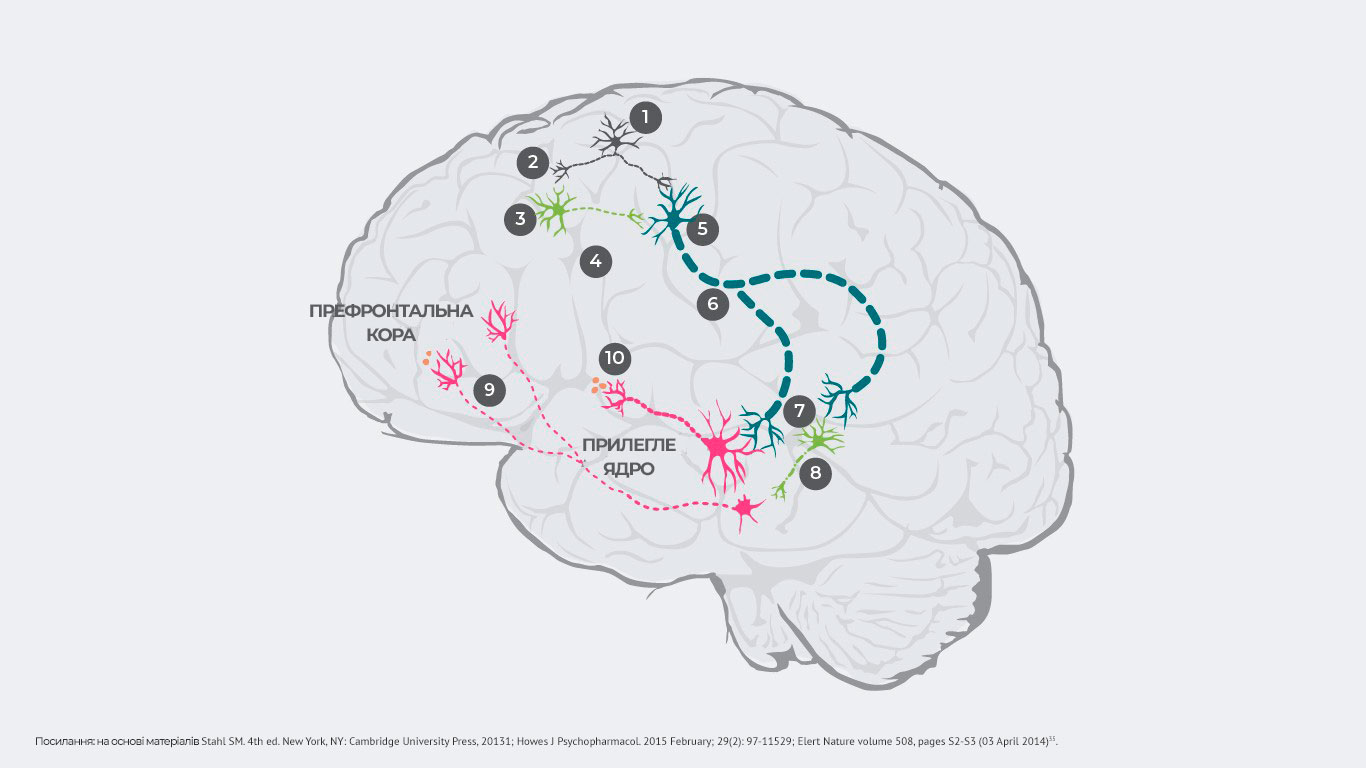
Патологічний процес запускає збудження глутаматних нейронів та передачу електричного імпульсу (№1), який спричиняє вивільнення глутамату в синапсі (№2).
У нормі глутамат зв’язується з рецепторами, які інгібують ГАМК (гамма-аміномасляну кислоту) та збудливими глутаматними нейронами. Але у пацієнтів із шизофренією порушується зв’язування глутамату з ГАМК-нейронами (№3), в результаті чого не вивільняються інгібіторні нейротрансмітери (№4). При цьому зв’язування глутамату зі збудливими глутаматними нейронами відбувається навіть за відсутності інгібуючих ГАМК-нейронів (№5), після чого посилений сигнал надсилається до стовбура головного мозку (№6).
Як наслідок, у синапсі вивільняється дуже велика кількість глутамату, який активує як дофамінові нейрони, так і інші інгібуючі ГАМК-нейрони (№7).
Надмірно стимульовані нейрони ГАМК надлишково інгібують інші дофамінові нейрони, тим самим пригнічуючи їх активність (№8). Такий гіпоактивний дофаміновий нейрон передає переривчасті сигнали з вентральної ділянки покришки до префронтальної кори. Вивільняється мінімальна кількість дофаміну (№9). Розвивається гіподофамінергічний стан у мезокортикальній системі. А він здатний провокувати появу негативних симптомів шизофренії1.
Гіперстимульовані дофамінові нейрони передають посилені сигнали з вентральної ділянки покришки до вентрального відділу смугастого тіла. Відбувається надмірне вивільнення дофаміну в цій ділянці (№10). Це призводить до гіпердофамінергічного стану в мезолімбічній системі, що може провокувати позитивні симптоми шизофренії1.
Дослідження підтверджують, що збільшення нейротрансмісії дофамінових
D2-рецепторів у підкірковій та лімбічній ділянці мозку може сприяти
проявам позитивних симптомів шизофренії31,32.
Але варто пам’ятати, що механізми, які спричиняють негативні й когнітивні
симптоми шизофренії, все ще недостатньо вивчені.
Наразі передбачається, що знижене вивільнення дофаміну в префронтальній
корі спричиняється активацією пресинаптичних дофамінових
D3-ауторецепторів у вентральній ділянці покришки, пов’язаної з
префронтальною корою.
Серед різноманітних підтипів дофамінових рецепторів
D3-рецептори мають найбільшу афінність до дофаміну.
На відміну від D1– або D2 рецепторів, стимуляція
D3-рецепторів можлива навіть в умовах зниженого вивільнення
дофаміну. Це може впливати на випадкові викиди дофаміну.
Блокування цього ослаблення перешкоджає інгібуванню вивільнення дофаміну й
посилює нейротрансмісію.
Це збільшення кількості дофаміну може усунути гіподофамінергічний стан і
призвести до полегшення негативних та когнітивних симптомів шизофренії за
допомогою активації D1-рецепторів у префронтальній корі,
неактивних в умовах низького рівня дофаміну
32.
Під час дослідів на тваринах, включаючи дослідження на приматах, було
показано, що оптимальний ефект щодо покращення когнітивних функцій
досягається при оптимізації активності D1-рецептора в
префронтальній корі.
Надлишкова кількість дофаміну, а також його недостатня кількість у
кортикальних D1-рецепторах, може бути пов’язана з когнітивною
дисфункцією.
Існує припущення, що лікарські засоби, які блокують або надмірно
стимулюють D1-рецептори, можуть провокувати порушення балансу
нейротрансмісії дофаміну в кіркових синапсах і спричиняти когнітивні,
негативні симптоми шизофренії та афективні розлади.
Також можливо, що антагоністи D3-рецепторів можуть перешкоджати
інгібуванню вивільнення дофаміну й гармонізувати кортикальні ланцюги. Дана
дія потенційно здатна регулювати вираженість когнітивних, негативних
симптомів шизофренії та афективних розладів4.
Джерела:
- Stahl, S. M. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. (Cambridge University Press, 2013).
- Seeman, P. Schizophrenia and dopamine receptors. Eur. Neuropsychopharmacol. 23, 999–1009 (2013).
- Kaar, S. J., Natesan, S., McCutcheon, R. & Howes, O. D. Antipsychotics: Mechanisms underlying clinical response and side-effects and novel treatment approaches based on pathophysiology. Neuropharmacology (2019). doi:10.1016/j.neuropharm.2019.107704
- Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017).
- Cools, R. & D’Esposito, M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry 69, e113-125 (2011).
- Hamid, A. A. et al. Mesolimbic dopamine signals the value of work. Nat. Neurosci. 19, 117-126. (2016).
- Koob, G. F., Caine, B., Markou, A., Pulvirenti, L. & Weiss, F. Role for the mesocortical dopamine system in the motivating effects of cocaine. NIDA Res. Monogr. Ser. 145, 1-18. (1994).
- Biesdorf, C. et al. Dopamine in the nucleus accumbens core, but not shell, increases during signaled food reward and decreases during delayed extinction. Neurobiol. Learn. Mem. 123, 125–139 (2015).
- Der-Avakian, A. & Markou, A. The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 35, 68–77 (2012).
- Leggio, G. M., Micale, V. & Drago, F. Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test (FST). Eur. Neuropsychopharmacol. 18, 271–277 (2008).
- Stahl, S. M. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim. Care Companion J. Clin. Psychiatry 5, 9–13 (2003).
- Plowman, E. K., Thomas, N. J. & Kleim, J. A. Striatal dopamine depletion induces forelimb motor impairments and disrupts forelimb movement representations within the motor cortex. J. Parkinsons. Dis. 1, 93–100 (2011).
- Dichter, G. S., Damiano, C. A. & Allen, J. A. Reward circuitry dysfunction in psychiatric and neurodevelopmental disorders and genetic syndromes: Animal models and clinical findings. J. Neurodev. Disord. 4, 19 (2012).
- Ashok, A. H. et al. The dopamine hypothesis of bipolar affective disorder: The state of the art and implications for treatment. Mol. Psychiatry 22, 666–679 (2017).
- Orio, L., Wee, S., Newman, A. H., Pulvirenti, L. & Koob, G. F. The dopamine D3 receptor partial agonist CJB090 and antagonist PG01037 decrease progressive ratio responding for methamphetamine in rats with extended-access. Addict. Biol. 15, 312–323 (2010).
- Volkow, N. D. et al. Methylphenidate-elicited dopamine increases in ventral striatum are associated with long-term symptom improvement in adults with attention deficit hyperactivity disorder. J. Neurosci. 32, 841–849 (2012).
- Beaulieu, J. M., Espinoza, S. & Gainetdinov, R. R. Dopamine receptors – IUPHAR review 13. Br. J. Pharmacol. 172, 1–23 (2015).
- Sunahara, R. K. et al. Cloning of the gene for a human dopamine D5 receptor with higher affinity for dopamine than D1. Nature 350, 614–619 (1991).
- Toll, L. et al. Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications. NIDA Res. Monogr 178, 440–466 (1998).
- Michaelides, M. R. et al. (5aR, 11bS)-4,5,5a,6,7, 11b-hexahydro-2-propyl-3-thia-5-azacyclopent-1-ena[c]-phenanthrene-9,10-diol (A-86929): A potent and selective dopamine D1 agonist that maintains behavioral efficacy following repeated administration and characterization of its dia. J. Med. Chem. 38, 3445–3447 (1995).
- Tallman, J. F. et al. Ngd 94-1 – identification of a noval, high-affinity antagonist at the human dopamine D-4 receptor 1. J. Pharmacol Exp Ther 282, 1011–1019 (1997).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Mengod, G. et al. Visualization of dopamine D1, D2 and D3 receptor mRNA’s in human and rat brain. Neurochem. Int. 20, Suppl:33S-43S (1992).
- Meador-Woodruff, J. H. et al. Dopamine receptor mRNA expression in human striatum and neocortex. Neuropsychopharmacology 15, 17–29 (1996).
- Fuxe, K. et al. Dopaminergic Systems in the Brain and Pituitary. in Basic and Clinical Aspects of Neuroscience (eds. Flückinger, E., Müller, E. E. & Thorner, M. O.) (Springer, 1985). doi:10.1007/978-3-642-69948-1_2
- Fatemi, S. H. & Clayton, P. J. The medical basis of psychiatry: Fourth edition. The Medical Basis of Psychiatry: Fourth Edition (2016). doi:10.1007/978-1-4939-2528-5
- Howes, O. D. & Kapur, S. The dopamine hypothesis of schizophrenia: Version III – The final common pathway. Schizophr. Bull. 35, 549–562 (2009).
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizophrenia: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Desbonnet, L. Modeling the Psychopathological Dimensions of Schizophrenia. in Handbook of Behavioural Neuroscience 267–284 (2016).
- Toda, M. & Abi-Dargham, A. Dopamine hypothesis of schizophrenia: Making sense of it all. Curr. Psychiatry Rep. 9, 329–336 (2007).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Grace, A. A. & Gomes, F. V. The circuitry of dopamine system regulation and its disruption in schizophrenia: Insights into treatment and prevention. Schizophr. Bull. 45, 148–157 (2019).
- Grace, A. A. Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 17, 524–532 (2016).
- Elert, E. Aetiology: Searching for schizophrenia’s roots. Nature 508, S2-3 (2014).
CNS Spectrums
Дивовижне домінування дофаміну: клінічна роль D3-, D2– та D1-рецепторів
Механізм дії антипсихотиківМеханізм дії антипсихотиків
(Реагіла® УКР: UA/17545/01/01, UA/17545/01/02, UA/17545/01/03, UA/17545/01/04 від 12.08.2019) Клінічна ефективність типових антипсихотичних препаратів, судячи з(Реагіла® УКР: UA/17545/01/01, UA/17545/01/02, UA/17545/01/03, UA/17545/01/04 від 12.08.2019) Клінічна ефективність типових антипсихотичних препаратів, судячи з
Далі…Механізм дії препарату Реагіла®Механізм дії препарату Реагіла®
(Реагіла® УКР: UA/17545/01/01, UA/17545/01/02, UA/17545/01/03, UA/17545/01/04 від 12.08.2019) Терапевтичний ефект карипразину забезпечується комбінацією частков(Реагіла® УКР: UA/17545/01/01, UA/17545/01/02, UA/17545/01/03, UA/17545/01/04 від 12.08.2019) Терапевтичний ефект карипразину забезпечується комбінацією частков
Далі…